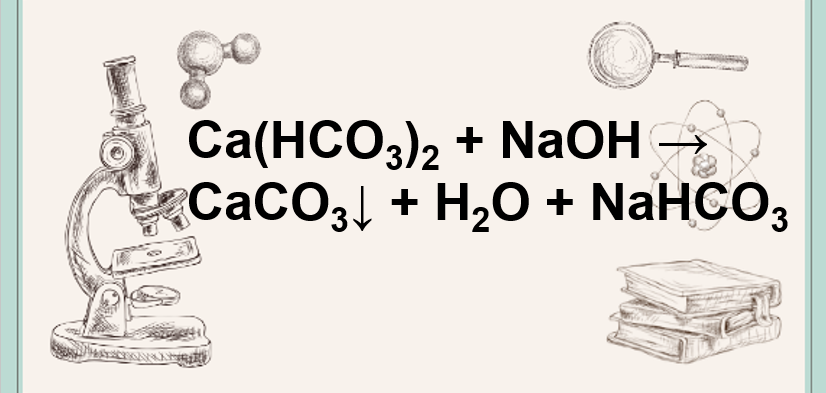Phản ứng Na + H2O là một phản ứng hóa học giữa natri và nước, tạo thành hidroxit natri và sản phẩm khí hiđro. Đây là một phản ứng hóa học phổ biến, được sử dụng trong nhiều ứng dụng khác nhau, từ sản xuất khí hiđro đến làm sạch kim loại. Ngoài ra, phản ứng Na + H2O cũng có thể được sử dụng để giải thích một số hiện tượng tự nhiên, như hoạt động của một số loại đất khô hoặc việc sản xuất năng lượng từ năng lượng mặt trời.
Mục lục bài viết
1. Phương trình Na tác dụng với H2O:
1.1. Cân bằng:
2Na + 2H2O → 2NaOH + H2
1.2. Điều kiện phản ứng giữa kim loại Na với H2O:
Điều kiện phản ứng: Không có
2. Cách thực hiện phản ứng kim loại Na với H2O:
Khi thêm mẫu natri vào cốc nước cất, hãy chắc chắn rằng bạn đang sử dụng đúng lượng mẫu và cốc phải được đặt trên một bề mặt phẳng. Trong quá trình thêm, bạn cần phải nhìn chăm chú vào cốc để đảm bảo rằng mẫu natri không bị rơi ra ngoài. Sau khi thêm mẫu, hãy khuấy đều cho đến khi mẫu tan hoàn toàn. Bạn có thể sử dụng mẫu natri tan để thực hiện các thí nghiệm khác nhau trong phòng thí nghiệm, ví dụ như phản ứng hoá học giữa mẫu natri và axit hoặc mẫu natri và nước brom. Hãy luôn luôn đọc kỹ hướng dẫn trước khi thực hiện bất kỳ thí nghiệm nào!
3. Hiện tượng nhận biết phản ứng kim loại Na với H2O:
Khi Natri phản ứng với nước, quá trình này diễn ra khá nhanh chóng. Nóng chảy thành giọt tròn, Natri có màu trắng và chuyển động trên mặt nước. Khi phản ứng tiếp diễn, mẫu Natri tan dần cho đến hết và có khí Hidro (H2) bay ra. Quá trình này tạo ra nhiều nhiệt, cho thấy rằng phản ứng này là một phản ứng toả nhiệt. Khi dung dịch bắt đầu bay hơi, ta sẽ được một chất rắn trắng, và đó chính là Natri Hidroxit (NaOH). Chất này có nhiều ứng dụng trong cuộc sống, ví dụ như trong sản xuất giấy, mỹ phẩm, thuốc nhuộm, và cả trong sản xuất hóa chất khác. Ngoài ra, phản ứng giữa Natri và nước còn là một ví dụ tuyệt vời về sự tương tác giữa các yếu tố hóa học và vật lý, mang tính quan trọng trong việc nghiên cứu và hiểu về khoa học tự nhiên.
4. Tính chất hóa học của kim loại kiềm:
Các nguyên tử kim loại kiềm có năng lượng ion hóa I1 thấp và thế điện cực chuẩn E0 có giá trị rất âm. Vì vậy, kim loại kiềm có tính khử rất mạnh, giúp chúng được sử dụng trong nhiều ứng dụng khác nhau trong đời sống và công nghiệp. Chúng ta hãy cùng tìm hiểu thêm về các tác dụng của kim loại kiềm với các phi kim khác nhau trong phần tiếp theo.
4.1. Tác dụng với phi kim:
Hầu hết các kim loại kiềm có thể khử được các phi kim. Ví dụ, kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hóa -1. Các kim loại kiềm khác cũng có thể tương tác với các phi kim khác để tạo ra các hợp chất mới có tính chất khác nhau.
Tác dụng với Oxi
Natri cháy trong khí oxi khô tạo ra natri peoxit Na2O2, trong không khí khô ở nhiệt độ thường tạo ra natri oxit Na2O. Các kim loại kiềm khác cũng có thể tương tác với oxi để tạo ra các hợp chất mới. Ví dụ, khi natri tác dụng với khí oxi trong môi trường ẩm, ta cũng có thể thu được natri oxit Na2O.
2Na + O2 → Na2O2
2Na + 1/2O2 → Na2O
Tác dụng với Clo
Các kim loại kiềm cũng có thể tương tác với clo để tạo ra các hợp chất mới. Ví dụ, khi hòa tan kim loại K trong khí clo, ta có phản ứng:
2K + Cl2 → 2KCl
Với halogen, lưu huỳnh:
Các kim loại kiềm có tính chất khử rất mạnh, nên chúng có thể bốc cháy trong khí clo khi có mặt hơi ẩm ở nhiệt độ cao. Với brom lỏng, K, Rb, Cs nổ mạnh, Li và Na chỉ tương tác trên bề mặt. Với iot, các kim loại kiềm chỉ tương tác mạnh khi đun nóng. Khi nghiền kim loại kiềm với bột lưu huỳnh sẽ gây phản ứng nổ. Ngoài ra, các kim loại kiềm còn có thể tác dụng với lưu huỳnh để tạo ra các hợp chất mới như sulfat và sulfua.
Với nitơ, cacbon, silic:
Các kim loại kiềm chỉ có thể tương tác trực tiếp với một số phi kim như nitơ, cacbon, silic. Ví dụ, chỉ có Li có thể tương tác trực tiếp với nitơ để tạo ra Li3N, Li2C2, Li6Si2 khi đun nóng. Tuy nhiên, các tác dụng của các kim loại kiềm với các phi kim khác nhau vẫn còn rất nhiều điều thú vị để khám phá.
Trong công nghiệp, các kim loại kiềm được sử dụng để sản xuất các hợp chất hữu cơ, giúp tăng độ tan của kim loại trong dung dịch, sản xuất pin điện hóa, các loại dung môi và chất bảo quản. Ngoài ra, các kim loại kiềm còn được sử dụng trong công nghiệp thuỷ tinh, sản xuất xà phòng và trong sản xuất đèn plasma. Vì vậy, hiểu rõ về các tác dụng của kim loại kiềm sẽ giúp chúng ta hiểu rõ hơn về các ứng dụng của chúng trong đời sống và công nghiệp.
4.2. Kim loại kiềm tác dụng với axit:
Trong hóa học, các kim loại kiềm thường được biết đến với khả năng khử ion H+ của dung dịch axit (HCl, H2SO4 loãng) một cách dễ dàng, dẫn đến phản ứng giữa kim loại kiềm và axit tạo thành khí H2 (phản ứng gây nổ nguy hiểm). Ví dụ, khi cho 2 li tác dụng với 2HCl, ta thu được 2LiCl và H2↑.
Công thức tổng quát cho phản ứng giữa kim loại kiềm và axit: 2M + 2H+ → 2M+ + H2↑.
4.3. Kim loại kiềm tác dụng với nước H2O:
Kim loại kiềm còn có khả năng khử nước dễ dàng, giải phóng khí hiđro. Chẳng hạn, khi cho 2Na tác dụng với 2H2O, ta thu được 2NaOH (dd) và H2↑.
Công thức tổng quát cho phản ứng giữa kim loại kiềm và nước: 2M + 2H2O → 2MOH (dd) + H2↑.
Các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa vì tính chất dễ bị oxy hóa của chúng khi tiếp xúc với không khí.
5. Bài tập vận dụng liên quan:
Câu 1. Trong nhóm kim loại kiềm thổ:
A. Tính khử của kim loại tăng khi bán kính nguyên tử tăng
B. Tính khử của kim loại tăng khi bán kính nguyên tử giảm
C. Tính khử của kim loại giảm khi bán kính nguyên tử tăng
D. Tính khử của kim loại không đổi khi bán kính nguyên tử giảm
Đáp án A: Tính khử của kim loại tăng khi bán kính nguyên tử tăng
Câu 2. Nhận định nào sau đây không đúng về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối.
B. Dễ bị oxi hóa.
C. Năng lượng ion hóa thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì.
D. Là những nguyên tố mà nguyên tử có 1 e ở phân lớp p.
Đáp án B
Nhận định nào sau đây không đúng về kim loại kiềm?
Dễ bị oxi hóa => dễ bị khử
Câu 3. Dung dịch kiềm không có những tính chất hóa học nào sau đây
A. Tác dụng với oxit bazơ
B. Tác dụng với axit
C. Tác dụng với dung dịch oxit axit
D. Bị nhiệt phân hủy
Đáp án A
Dung dịch kiềm không có tính chất hóa học là Tác dụng với oxit bazơ
Câu 4. Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh
B.Tác dụng với oxit axit tạo thành muối và nước
C.Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Đáp án D
Dung dịch KOH không có tính chất hoá học đó là Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Chỉ có bazo không tan bị nhiệt phân hủy thành oxit và nước
Câu 5. Một học sinh nghiên cứu một dung dịch X đựng trong một lo không dán nhãn và thu được kết quả sau: X có phản ứng với cả 3 dung dịch NaHSO4, Na2CO3 và AgNO3 X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3 Vậy dung dịch X là dung dịch nào sau đây
A. BaCl2
B. Mg(NO3)2
C. FeCl2
D. CuSO4
Đáp án A
A đúng vì BaCl2 thỏa mãn hết các tính chất của X
B sai vì Mg(NO3)2 không tác dụng với NaHSO4 AgNO3
C sai vì FeCl2 không tác dụng với NaHSO4
D sai vì CuSO4 không tác dụng với NaHSO4
Cau 6. Cho các phát biểu sau về ứng dụng của kim loại kiềm:
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4
Đáp án C
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
Câu 7. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Đáp án A
Gọi công thức chung của 2 kim loại kiềm là M
Phản ứng xảy ra
M + H2O→ MOH + 1/2H2
nM = 2nH2 = 0,16 mol => M = 3,36/0,16 = 21
=> Li (7)< M = 21 < K (39)
Gọi số mol của K và Li lần lượt là x và y:
Ta có:
% mLi = 0,09.7/3,36 .100% = 18,75%
Câu 8. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Đáp án A
A sai vì Na2CO3 không bị nhiệt phân
B, C, D đúng
Câu 9. Cho các chất sau : Na, Na2O, NaCl, NaHCO3, Na2CO3. Số chất có thể tạo ra NaOH trực tiếp từ một phản ứng là:
A. 2
B. 3
C. 4.
D. 5.
Đáp án D
Các chất đó là: Na2O; NaCl; Na2CO3, NaHCO3, Na
Na + H2O → NaOH + H2
Na2O + H2O → NaOH
2NaCl + 2H2O 2NaOH + H2 + Cl2
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
NaHCO3 + Ba(OH)2 → BaCO3↓ + NaOH + H2O
=> cả 5 chất đều có thể điều chế trực tiếp ra NaOH bằng một phản ứng.
Câu 10. Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau :
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án D
Cả 4 dự đoán đều đúng.
Chiếc thuyền làm bằng giấy thấm nước làm cho mẩu Na phản ứng với nước.
Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
Khí H2 sinh ra đẩy mẩu Na cũng như đẩy chiếc thuyền chạy vòng quanh chậu nước.
Phản ứng trên tỏa nhiều nhiệt khiến cho chiếc thuyền bốc cháy, mẩu Na nóng chảy và vo tròn lại (do sức căng bề mặt).
Vì NaOH là dung dịch bazơ ⇒ n hỏ phenolphtalein làm dung dịch chuyển màu hồng.