Phương trình điện li H2S? H2S là chất điện li mạnh hay yếu? là câu hỏi được nhiều bạn học sinh thắc mắc trong quá trình học tập môn Hóa học. Dưới đây là bài viết liên quan đến phương trình điện li H2S, mời các bạn cùng tham khảo bài viết dưới đây.
Mục lục bài viết
1. Viết phương trình điện li của H2S:
H2S ⇄ H+ + HS−
HS− ⇆ H+ +S2−
2. H2S là chất điện li yếu hay mạnh:
Chất điện li yếu được hiểu là chất khi tan trong nước, số phân tử hòa tan phân li một phần, phần còn lại sẽ vẫn còn tồn tại dưới dạng phân tử trong dung dịch.
Các axit yếu, bazơ yếu và một số muối là chất điện li yếu.
Những chất điện li yếu là:
Các axit yếu như CH3COOH, HClO, H2S, HF, H2SO3, …
Các bazơ yếu như: Bi(OH)2, Mg(OH)2, …
Ví dụ:
H2S ⇄ H+ + HS−
HS− ⇆ H+ + S2−
=> H2S là chất điện li yếu, bởi chất H2S là một axit yếu, H2S chỉ có 1 phần các phân tử hoà tan phân li ra ion, phần còn lại tồn tại dưới dạng phân tử trong dung dịch. Do đó, H2S thuộc nhóm chất điện li yếu.
3. Bài tập liên quan và lời giải:
Câu 1: Phương pháp để loại bỏ tạp chất HCl có lẫn trong khí H2S là: Cho hỗn hợp khí lội từ từ qua một lượng dư dung dịch
A. NaHS. B. Pb(NO3)2.
C. NaOH. D. AgNO3.
Lời giải: Đáp án A
NaHS + HCl → NaCl + H2S ↑
NaHS không phản ứng với H2S.
Câu 2: Phát biểu nào sau đây là đúng về phản ứng:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
Lời giải: Đáp án D
Số oxi hóa của Cl giảm từ 0 xuống -1, Cl2 là chất oxi hóa.
Số oxi hóa của S tăng từ -2 lên +6, H2S là chất khử.
Câu 3: Cho 2,24 lít khí H2S ở đktc phản ứng với dung dịch chứa 0,3 mol KOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 11 gam. B. 12 gam.
C. 11,5 gam. D. 10 gam.
Lời giải: Đáp án A

Câu 4: Trong các phản ứng sau đây, phản ứng nào sai?
A. H2S + 2NaCl → Na2S + 2HCl.
B. 2H2S + 3O2dư → 2SO2 ↑ + 2H2O.
C. H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
D. H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl.
Lời giải: Đáp án A
Không thỏa mãn điều kiện của phản ứng trao đổi.
Câu 5: Cho FeS tác dụng với dung dịch HCl, khí bay ra là
A. H2S. B. Cl2.
C. SO2. D. H2.
Lời giải: Đáp án A
FeS + 2HCl → FeCl2 + H2S↑
Câu 6: Cho phản ứng hoá học: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl. Vai trò của H2S trong phản ứng là
A. Chất khử. B. Môi trường.
C. Chất oxi hóa. D. Vừa oxi hóa, vừa khử.
Lời giải: Đáp án A
Số oxi hóa của S tăng từ -2 lên +6, H2S là chất khử.
Câu 7: Trong tự nhiên có rất nhiều nguồn sinh ra khí H2S như sự phân huỷ rác, chất thải… nhưng không có sự tích tụ H2S trong không khí. Nguyên nhân chính là
A. H2S ở thể khí.
B. H2S dễ bị oxi hóa bởi oxi trong không khí.
C. H2S dễ bị phân huỷ trong không khí.
D. H2S nặng hơn không khí.
Lời giải: Đáp án B
Câu 8: Người ta thường dùng các vật dụng bằng bạc để cạo gió cho người bị trúng gió (khi người bị mệt mỏi, chóng mặt…do trong cơ thể tích tụ các khí độc như H2S…). Khi đó vật bằng bạc bị đen do phản ứng:
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
Câu nào diễn tả đúng tính chất của các chất phản ứng?
A. Ag là chất oxi hoá, H2S là chất khử.
B. H2S là chất khử, O2 là chất oxi hoá.
C. Ag là chất khử, O2 là chất oxi hoá.
D. H2S vừa là chất oxi hoá, vừa là chất khử, Ag là chất khử.
Lời giải: Đáp án C
Số oxi hóa của Ag tăng từ 0 lên +1 → Ag là chất khử.
Số oxi hóa của O giảm từ 0 xuống -2 → O2 là chất oxi hóa.
Câu 9: Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, hiện tượng quan sát được là:
A. Dung dịch không màu chuyển sang màu tím.
B. Dung dịch màu tím bị vẩn đục màu vàng.
C. Màu tím của dung dịch KMnO4 chuyển sang màu vàng.
D. Màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng.
Lời giải: Đáp án D
5H2S + 2KMnO4 + 3H2SO4 → 5S↓ + 2MnSO4 + 8H2O + K2SO4
Câu 10: Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta lấy hai lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thấy có kết tủa màu đen xuất hiện. Hiện tượng này chứng tỏ trong không khí có hiện diện khí nào sau?
A. CO2. B. H2S.
C. NH3. D. SO2.
Lời giải: Đáp án B
Pb(NO3)2 + H2S → PbS (↓ đen) + 2HNO3
Câu 11: Dung dịch X chứa: FeCl3; CuCl2; AlCl3; NaCl, CdCl2; ZnCl2; MgCl2. Sục khí H2S đến dư vào dung dịch X. Số kết tủa khác nhau thu được là
A. 1. B. 2.
C. 4. D. 3.
Lời giải: Đáp án D
Các kết tủa thu được là: S; CuS; CdS
2FeCl3 + H2S → 2FeCl2 + S↓ + 2HCl
CuCl2 + H2S → CuS↓ + 2HCl
CdCl2 + H2S → CdS↓ + 2HCl
Câu 12: Dẫn a mol khí H2S vào dung dịch chứa b mol NaOH. Để sau phản ứng chỉ thu được một loại muối trung hòa thì
A. a/b > 2. B. b/a > 2.
C. b/a ≥ 2. D. 1 < b/a < 2.
Lời giải: Đáp án C
Sau phản ứng chỉ thu được một loại muối trung hòa

Câu 13: Cho dd CuSO4 tác dụng với khí H2S(lấy dư) thu được 9,6 g kết tủa.Tính thể tích H2S cần dùng(đktc)
A.2,24 B.6,72
C.3,36 D.kết quả khác
Lời giải: Đáp án A.
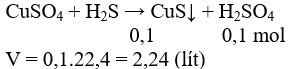
Câu 14: Một mẫu khí thải có chứa các khí H2S, NO2, SO2, CO2 được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải gây ra?
A. H2S. B. NO2.
C. SO2. D. CO2.
Lời giải: Đáp án A
CuSO4 + H2S → CuS↓ + H2SO4
Câu 15: Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2?
A. dung dịch HCl.
B. dung dịch Pb(NO3)2.
C. dung dịch K2SO4.
D. dung dịch NaCl.
Lời giải: Đáp án B
Pb(NO3)2 + H2S → 2HNO3 + PbS↓
CO2 không phản ứng.
Câu 16: Một mẫu khí thải công nghiệp có nhiễm các khí CO; CO2; H2S. Để nhận biết H2S ta dùng dung dịch:
A. Pb(CH3COO)2. B. FeSO4.
C. NaNO3. D. Ca(OH)2.
Lời giải: Đáp án A
H2S có phản ứng với Pb2+ tạo PbS kết tủa đen khác với CO và CO2 không xảy ra phản ứng.
Câu 17: Cho phương trình phản ứng:
H2S + KMnO4 + H2SO4 → S↓ + MnSO4 + H2O + K2SO4
Tổng hệ số tối giản của các chất thu được sau phản ứng là
A. 10. B. 16.
C. 26. D. 8.
Lời giải: Đáp án B.
5H2S + 2KMnO4 + 3H2SO4 → 5S↓ + 2MnSO4 + 8H2O + K2SO4
Tổng hệ số tối giản của các chất thu được sau phản ứng = 5 + 2 + 8 + 1 = 16.
Câu 18: Cho sơ đồ phản ứng sau:
![]()
Các chất X, Y lần lượt là:
A. SO2, hơi S. B. H2S, hơi S.
C. H2S, SO2. D. SO2,H2S.
Lời giải: Đáp án C
FeS + 2HCl → FeCl2 + H2S↑
2H2S + 3O2 → 2SO2↑ + 2H2O
Câu 19: H2S bị oxi hóa thành lưu huỳnh màu vàng khi:
1) Dẫn khí H2S qua dung dịch FeCl3
2) Để dung dịch H2S ngoài trời
3) Đốt khí H2S ở điều kiện thiếu oxi
A. 1 và 2 B. 1 và 3
C. 2 và 3 D. 1, 2 và 3
Lời giải: Đáp án D
Các phương trình phản ứng xảy ra:
H2S + 2FeCl3 → 2FeCl2 + S↑ + 2HCl
đốt H2S trong điều kiện thiếu oxi hay để dung dịch H2S trong không khí:
2H2S + O2 → 2S↓ + 2H2O
Câu 20: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Giá trị của m là
A. 16,5. B. 27,5.
C. 14,6. D. 27,7.
Lời giải: Đáp án D.

Câu 21: Cho 5,6 lít (đktc) hỗn hợp khí X gồm H2S và SO2 tác dụng hết với 1,25 lít dung dịch nước brom vừa đủ. Thêm tiếp vào dung dịch sau phản ứng Ba(NO3)2 dư, thu được m gam kết tủa trắng. Giá trị của m là
A. 116,50. B. 29,125.
C. 58,25. D. 291,25.
Lời giải: Đáp án C

Câu 22: Nhỏ HCl vào ống nghiệm chứa Na2S thu được hiện tượng là
A. Có khí không màu, mùi trứng thối thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Lời giải: Đáp án A
Na2S + 2HCl → 2NaCl + H2S↑
H2S: khí không màu, mùi trứng thối.
Câu 23: Thể tích khí ở dktc thoát ra khi cho 7,8g Na2S phản ứng hoàn toàn với lượng dư HCl là
A. 1,12 lít. B. 2,24 lít.
C. 3,36 lít. D. 4,48 lít.
Lời giải: Đáp án B

Câu 25: Dẫn từ từ đến dư H2S vào dung dịch NaOH thu được dung dịch X. Muối tan có trong dung dịch X là
A. Na2S. B. Na2S và NaHS.
C. NaHS. D. Na2S và NaOH.
Lời giải: Đáp án C
Do H2S dư nên có phản ứng
NaOH + H2S → NaHS + H2O
Muối tan có trong dung dịch X là NaHS.
Câu 26: Cho 2,24 lít khí H2S ở đktc phản ứng với dung dịch chứa 0,1 mol NaOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 5,6 gam. B. 7,2 gam.
C. 11,5 gam. D. 5,8 gam.
Lời giải: Đáp án A

Câu 27: Khí nào sau đây có mùi trứng thối?
A. SO2. B. H2S.
C. Cl2. D. CO2.
Lời giải: Đáp án B
Câu 28: Khí H2S điều chế trong PTN thường có lẫn hơi nước. Hóa chất có thể làm khô H2S là
A. CaCl2 khan. C. Dung dịch H2SO4 đặc.
B. CuSO4 khan. D. Dung dịch NaOH.
Lời giải: Đáp án A
H2S không phản ứng với CaCl2.
Câu 29: Cho các dd muối Pb(NO3)2 (1), Ba(NO3)2 (2), Ca(NO3)2 (3), Cu(NO3)2 (4). Dung dịch muối nào có thể dùng nhận biết H2S?
A. 1, 2, 3, 4. B. 1, 4.
C. 1, 2. D. 1, 2, 3.
Lời giải: Đáp án B
Pb(NO3)2 + H2S → 2HNO3 + PbS(↓ đen)
Cu(NO3)2 + H2S → 2HNO3 + CuS(↓ đen)
Câu 30: Tại một phòng thí nghiệm, để kiểm tra hàm lượng hidro sunfua có trong mẫu khí lấy từ bãi rác, người ta cho mẫu đó đi vào dung dịch chì nitrat dư tốc độ 2,5 lít/phút trong 400 phút. Lọc tách kết tủa thu được 4,78 mg chất rắn màu đen. Hàm lượng hiđrosunfua có trong mẫu khí đó (theo đơn vị mg/m3) là
A. 4,78. B. 0,68.
C. 6,8. D. 7,8.
Lời giải: Đáp án B
Vkhí = 2,5.400 = 1000 lít = 1000dm3 = 1m3
![]()
Hàm lượng hiđrosunfua = (2.10-5.34):1= 6,8.10-4g = 0,68mg.