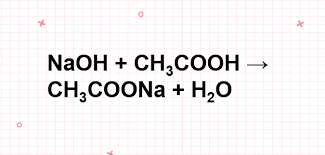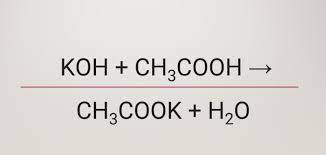Phản ứng hóa học giữa CH3COOH, LiAlH4 và H2O là một phản ứng vô cùng quan trọng trong hóa học hữu cơ. Đây là một phản ứng khử mạnh, trong đó CH3COOH được khử bởi LiAlH4 để tạo ra C2H5OH, LiOH và Al(OH)3. Công thức hóa học của phản ứng là: CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3
Mục lục bài viết
1. Phản ứng hóa học giữa CH3COOH, LiAlH4, và H2O:
Phản ứng hóa học giữa CH3COOH, LiAlH4 và H2O là một phản ứng vô cùng quan trọng trong hóa học hữu cơ. Đây là một phản ứng khử mạnh, trong đó CH3COOH được khử bởi LiAlH4 để tạo ra C2H5OH, LiOH và Al(OH)3.
Công thức hóa học của phản ứng là: CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3
Trong phản ứng này, LiAlH4 là chất khử mạnh và có khả năng khử các nhóm chức có tính oxi hóa cao như nhóm carboxyl trong CH3COOH. Khi LiAlH4 tương tác với CH3COOH, nó trao đổi electron với nhóm carboxyl, giảm tính oxi hóa của nhóm chức này và chuyển đổi thành C2H5OH.
Quá trình này xảy ra khi LiAlH4 cung cấp các electron cho nhóm carboxyl của CH3COOH, làm giảm số lượng electron trên nhóm carboxyl. Sự chuyển đổi này giảm tính oxi hóa của nhóm carboxyl và tạo ra một ion anion hoá trị thấp hơn, làm cho các nguyên tử C trong nhóm carboxyl có thể phân bổ các electron đó với nhau hơn. Điều này dẫn đến sự chuyển đổi của nhóm carboxyl thành nhóm alcohol.
Trong quá trình phản ứng, H2O được sử dụng để giải phóng các sản phẩm khử và tạo ra LiOH và Al(OH)3. Cụ thể, H2O tham gia vào quá trình hydrolysis để tạo ra các sản phẩm khử và các ion hydroxyl.
Khả năng khử mạnh của LiAlH4 là do khả năng của liên kết Al-H trong phân tử. LiAlH4 có thể cung cấp các electron để khử các nhóm chức có tính oxi hóa cao bằng cách tham gia vào quá trình trao đổi electron với nhóm chức đó. Điều này làm giảm tính oxi hóa của nhóm chức đó và tạo ra các sản phẩm khử.
Phản ứng hóa học giữa CH3COOH, LiAlH4 và H2O là một quá trình quan trọng trong tổng hợp hữu cơ và làm sạch. Nó được sử dụng rộng rãi trong các lĩnh vực như sản xuất thuốc, hóa chất và công nghệ thực phẩm. Phản ứng này là một phương pháp rẻ tiền, hiệu quả và đáng tin cậy để tạo ra các sản phẩm hữu cơ với tính chất đặc biệt.
Tuy nhiên, cần phải lưu ý rằng phản ứng này cũng có thể gây ra các hiện tượng phụ như cháy nổ hoặc phát nhiệt quá mức nếu không được thực hiện đúng cách. Do đó, việc nghiên cứu và áp dụng phản ứng này cần phải được thực hiện bởi những người có kiến thức và kinh nghiệm chuyên sâu trong lĩnh vực hóa học hữu cơ.
2. Điều kiện xảy ra phản ứng CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3:
Phản ứng hóa học là một quá trình cực kỳ quan trọng trong đời sống hàng ngày và các lĩnh vực khoa học công nghiệp. Tuy nhiên, để phản ứng hóa học diễn ra được hiệu quả và tạo ra sản phẩm mong muốn, cần đáp ứng đầy đủ các điều kiện cần thiết.
Trong trường hợp phản ứng CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3, cần có các điều kiện sau:
2.1. Nhiệt độ:
Phản ứng được thực hiện trong môi trường có nhiệt độ từ 0 độ C đến 25 độ C. Nhiệt độ phù hợp được xác định dựa trên một số yếu tố, bao gồm nhiệt độ phân huỷ của các chất, tốc độ phản ứng và hiệu suất phản ứng. Nhiệt độ quá cao hoặc quá thấp đều có thể làm giảm hiệu suất của phản ứng.
2.2. Chất xúc tác:
Trong phản ứng này, chất xúc tác được sử dụng là LiAlH4 và H2O. Chúng có tác dụng kích thích phản ứng xảy ra một cách hiệu quả hơn. Chất xúc tác là một yếu tố rất quan trọng trong phản ứng hóa học, nó giúp tăng tốc độ phản ứng và tăng hiệu suất của phản ứng. Ngoài ra, chất xúc tác còn cho phép các phản ứng xảy ra ở nhiệt độ thấp hơn so với không sử dụng chất xúc tác.
2.3. Không khí:
Phản ứng được thực hiện trong không khí khô, tránh tiếp xúc với nước và không khí ẩm để tránh phản ứng phụ. Điều này đảm bảo rằng phản ứng chỉ diễn ra giữa các chất tham gia, và không bị ảnh hưởng bởi các yếu tố ngoài môi trường. Các phản ứng phụ có thể xảy ra khi không khí ẩm hoặc khi có các chất khác tác động vào phản ứng, do đó, việc kiểm soát môi trường là rất quan trọng trong các phản ứng hóa học.
2.4. Đủ lượng chất:
Phải sử dụng đủ lượng chất để phản ứng hoàn toàn và đạt hiệu suất tối đa. Việc chuẩn bị đủ lượng chất tham gia là rất quan trọng để phản ứng diễn ra một cách hiệu quả và đạt được sản phẩm mong muốn. Nếu lượng chất không đủ, phản ứng sẽ không diễn ra hoàn toàn, và nếu lượng chất quá nhiều, có thể dẫn đến sự lãng phí nguyên liệu.
Như vậy, để phản ứng CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3 xảy ra thành công, chúng ta cần đáp ứng đầy đủ các điều kiện trên. Bằng cách đảm bảo các điều kiện phù hợp cho phản ứng, chúng ta có thể tạo ra sản phẩm mong muốn một cách hiệu quả và đạt được hiệu suất tối đa. Ngoài ra, các điều kiện này cũng có thể áp dụng cho các phản ứng hóa học khác, và giúp đảm bảo phản ứng xảy ra một cách hiệu quả và đạt được sản phẩm mong muốn. Việc tìm hiểu về các điều kiện cần thiết cho phản ứng hóa học là rất quan trọng, giúp chúng ta hiểu rõ hơn về cách thức hoạt động của các phản ứng và áp dụng chúng để tạo ra các sản phẩm hữu ích.
3. Ứng dụng của phản ứng CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3:
Phản ứng trên là một phản ứng khử, trong đó chất LiAlH4 được sử dụng làm chất khử. Đây là phản ứng quan trọng trong tổng hợp hữu cơ, đặc biệt là trong việc chuyển đổi các nhóm chức có chứa cacbonil thành các nhóm chức khác. Nhóm chức cacbonil, như aldehyd và chất keton, thường xuất hiện trong các hợp chất hữu cơ, ví dụ như các chất đơn giản như axit cacboxylic và este.
Phản ứng trên cũng được sử dụng để tổng hợp rượu từ axit cacboxylic. Trong phản ứng này, axit cacboxylic được khử bởi LiAlH4, tạo ra rượu và các sản phẩm phụ LiOH và Al(OH)3. Ngoài ra, phản ứng này còn được sử dụng để chuyển đổi các amit, nitro, và các nhóm chức khác thành các nhóm chức khác, như amin và ancol.
Ngoài ra, phản ứng trên còn có nhiều ứng dụng khác. Ví dụ, nó được sử dụng để chuyển đổi các nhóm chức thơm và các hợp chất chứa nhóm chức halogen thành các nhóm chức khác. Nó cũng được sử dụng để chuyển đổi các amin và nitro thành các amin thứ cấp và amin bậc ba. Ngoài ra, phản ứng này còn có thể được sử dụng để khử các liên kết đôi và liên kết ba, tạo ra các sản phẩm khác nhau tùy thuộc vào điều kiện phản ứng cụ thể.
Phản ứng trên cũng có thể được sử dụng để tái chế các chất thải hữu cơ, đặc biệt là các chất thải có chứa axit cacboxylic. Khi được xử lý với LiAlH4 và H2O, các chất thải này có thể được chuyển đổi thành rượu và các sản phẩm phụ không độc hại. Điều này giúp giảm thiểu sự lãng phí trong sản xuất và giúp giảm tác động tiêu cực đến môi trường.
Tóm lại, phản ứng CH3COOH + LiAlH4 + H2O → C2H5OH + LiOH + Al(OH)3 có rất nhiều ứng dụng trong tổng hợp hữu cơ và tái chế chất thải hữu cơ. Các ứng dụng này đóng vai trò quan trọng trong việc sản xuất các hợp chất hữu cơ và giúp giảm thiểu tác động tiêu cực đến môi trường. Điều này làm cho phản ứng này trở thành một trong những phản ứng quan trọng nhất trong lĩnh vực hóa học hữu cơ.
4. Câu hỏi trắc nghiệm liên quan:
Câu 1: Yếu tố nào không làm tăng hiệu suất phản ứng este hóa giữa axit axetic và etanol?
A. Dùng H2SO4 đặc làm xúc tác
B. Chưng cất este tạo ra
C. Tăng nồng độ axit hoặc ancol
D. Lấy số mol ancol và axit bằng nhau
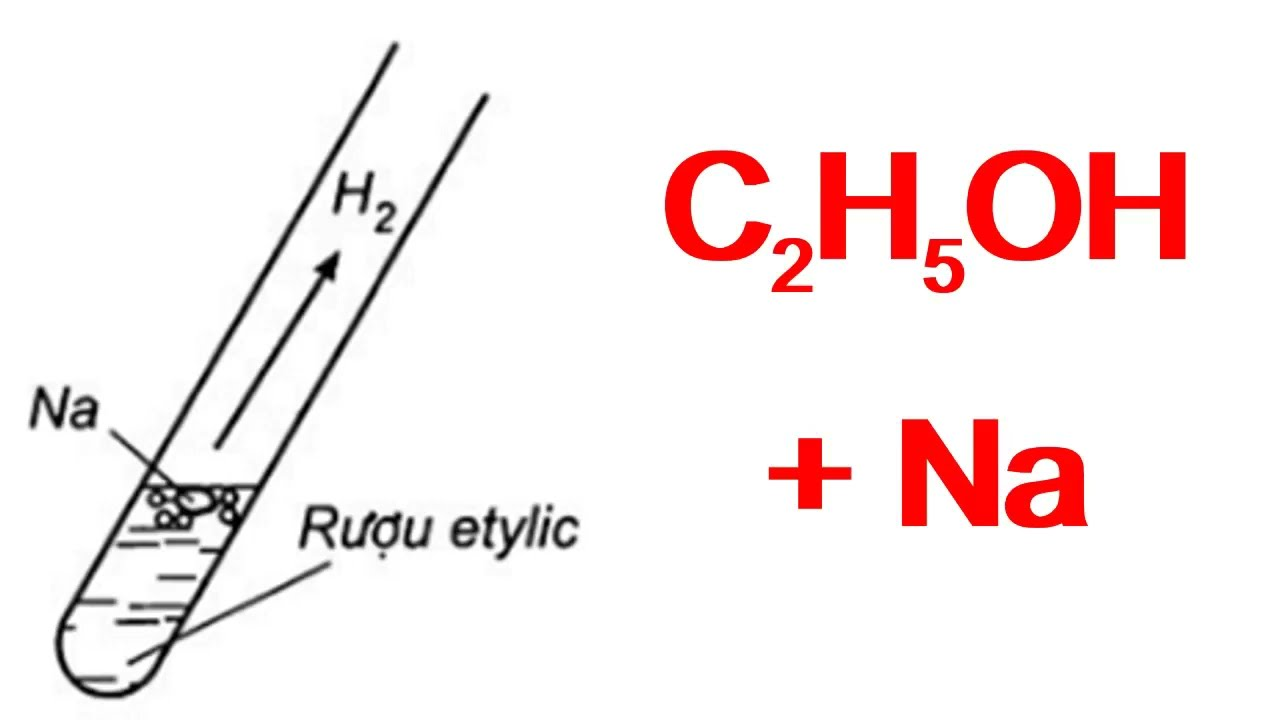
Câu 2: Vì sao nhiệt độ sôi của axit thường cao hơn ancol tương ứng?
A. Vì ancol không có liên kết hidro, axit có liên kết hidro
B. Vì liên kết hidro của axit bền hơn của ancol
C. Vì khối lượng phân tử của axit lớn hơn
D. Vì axit có 2 nguyên tử oxi
Câu 3: Giấm ăn là dung dịch axit axetic có nồng độ từ
A. 2% đến 5%
B. 6% đến 10%
C. 11% đến 14%
D. 15% đến 18%
Câu 4: Chia a gam axit axetic thành 2 phần bằng nhau:
Phần 1: trung hòa vừa đủ bởi 0,5 lít dung dịch NaOH 0,4 M
Phần 2: thực hiện phản ứng este hóa với ancol etylic thu được m gam este ( giả sử hiệu suất phản ứng là 100%)
Vậy m có giá trị là:
A. 16,7 gam
B. 17,6 gam
C. 16,8 gam
D. 18,6 gam
Câu 5: Cho các phản ứng sau ở điều kiện thích hợp:
(1) Lên men giấm ancol etylic
(2) Oxi hóa không hoàn toàn andehit axetic
(3) Oxi hóa không hoàn toàn Butan
(4) Cho metanol tác dụng với cacbon oxit
Trong những phản ứng trên, số phản ứng tạo ra axit axetic là?
A. 1
B. 2
C. 3
D. 4
Đáp án D