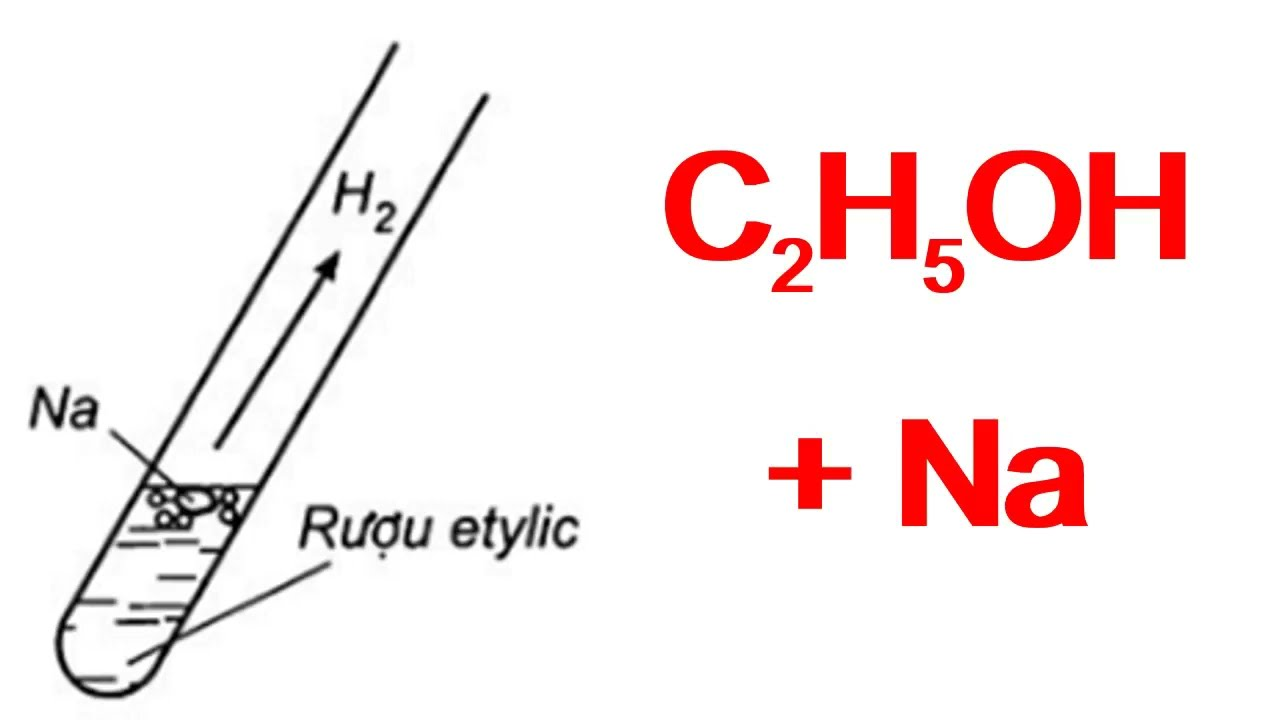
CH3CHO + H2 → C2H5OH được biên soạn là phương pháp điều chế ancol etylic từ anđehit axetic. Với nhiệt độ xúc tác thích hợp ta sẽ thu được etanol. Hy vọng với nội dung phương trình này sẽ giúp bạn đọc viết chính xác phản ứng cũng như vận dụng tốt vào giải bài tập ancol etylic.
Mục lục bài viết
- 1 1. Phương trình phản ứng CH3CHO ra C2H5OH:
- 2 2. Phân tích phản ứng CH3CHO ra C2H5OH:
- 2.1 2.1. Điều kiện phản ứng điều chế ancol etylic xảy ra:
- 2.2 2.2. Hiện tượng nhận biết xảy ra phản ứng CH3CHO + H2 → C2H5OH:
- 2.3 2.3. Thực hiện phản ứng CH3CHO + H2 → C2H5OH như thế nào?
- 2.4 2.4. Phương trình ion của phản ứng CH3CHO + H2 → C2H5OH:
- 2.5 2.5. Cân bằng phương trình CH3CHO + H2 → C2H5OH:
- 2.6 2.6. Ứng dụng của Phản ứng CH3CHO + H2 → C2H5OH:
- 3 3. Bài tập vận dụng liên quan:
- 4 4. Hướng dẫn lời giải:
1. Phương trình phản ứng CH3CHO ra C2H5OH:
CH3CHO + H2 Ni, t0 > C2H5OH
Đây là phản ứng hiđrô hóa của aldehit. Trong phản ứng này, một nhóm hiđrô được thêm vào nhóm cacbonyl của CH3CHO để tạo ra C2H5OH, hay còn gọi là rượu etylic. Phản ứng thuộc loại phản ứng khử, trong đó aldehit axetic bị khử thành rượu etylic bởi hidro. Sản phẩm của phản ứng là rượu etylic, một chất lỏng không màu, tan tốt trong nước và có mùi đặc trưng.
Phản ứng này có thể xảy ra trong môi trường kiềm hoặc axit, với sự có mặt của xúc tác kim loại như niken, bạc hoặc bạch kim. Phản ứng này có ý nghĩa trong công nghiệp hóa chất, vì rượu etylic là một hợp chất quan trọng được sử dụng trong nhiều lĩnh vực như dung môi, nhiên liệu, chất khử trùng và chất tạo mùi.
2. Phân tích phản ứng CH3CHO ra C2H5OH:
2.1. Điều kiện phản ứng điều chế ancol etylic xảy ra:
Phản ứng CH3CHO + H2 → C2H5OH là phản ứng khử của anđehit axetic với hiđrô để tạo ra rượu etylic. Điều kiện xảy ra phản ứng này là cần có một chất xúc tác kim loại như niken, bạc hoặc đồng, và nhiệt độ cao khoảng 200 độ C.
– Cơ chế phản ứng: Phản ứng giữa CH3CHO và H2 thuộc loại phản ứng khử, trong đó CH3CHO bị khử thành C2H5OH bởi H2. Cơ chế phản ứng này là cơ chế thế nhiệt động học, tức là phản ứng xảy ra theo hướng giảm năng lượng tự do Gibbs. Điều này có nghĩa là phản ứng sẽ xảy ra khi nhiệt độ và áp suất caocao, vì như vậy sẽ tạo ra sản phẩm có năng lượng tự do Gibbs thấp hơn.
– Chất xúc tác: Phản ứng giữa CH3CHO và H2 cần có sự hiện diện của một chất xúc tác để tăng tốc độ phản ứng. Chất xúc tác thường được dùng cho phản ứng này là các kim loại nhóm VIII như Ni, Pt, Pd, Rh hay Ru. Chất xúc tác sẽ cung cấp bề mặt cho các phân tử CH3CHO và H2 tiếp xúc với nhau, và cũng giúp kích hoạt các liên kết trong các phân tử này để dễ dàng bị phá vỡ và tạo ra sản phẩm.
– Nồng độ và tỉ lệ mol: Phản ứng giữa CH3CHO và H2 cũng phụ thuộc vào nồng độ và tỉ lệ mol của hai chất phản ứng. Theo định luật Le Chatelier, khi nồng độ của một chất phản ứng tăng lên, phản ứng sẽ diễn biến theo hướng tiêu thụ chất đó. Do đó, để tăng hiệu suất của phản ứng, chúng ta nên duy trì nồng độ cao của CH3CHO và H2. Tuy nhiên, nếu nồng độ quá cao, sẽ gây ra hiện tượng ngưng tụ hoặc bão hòa, làm giảm bề mặt tiếp xúc của các phân tử với chất xúc tác. Vì vậy, chúng ta cần điều chỉnh nồng độ sao cho phù hợp với điều kiện thực tế. Ngoài ra, tỉ lệ mol của CH3CHO và H2 cũng ảnh hưởng đến phản ứng. Theo phương trình cân bằng, tỉ lệ mol lý tưởng của hai chất này là 1:1. Tuy nhiên, trong thực tế, chúng ta thường dùng một lượng dư của H2 để đảm bảo rằng CH3CHO được khử hoàn toàn.
2.2. Hiện tượng nhận biết xảy ra phản ứng CH3CHO + H2 → C2H5OH:
Hiện tượng nhận biết xảy ra phản ứng CH3CHO + H2 → C2H5OH là:
– có mùi rượu etylic thoát ra.
– có sự giảm nồng độ của CH3CHO và tăng nồng độ của C2H5OH trong dung dịch. Ngoài ra, có thể dùng các chỉ thị màu để phát hiện sự hiện diện của aldehit và rượu. Ví dụ, nếu dùng dung dịch Fehling A và B, thì CH3CHO sẽ làm dung dịch chuyển sang màu đỏ gạch do hình thành kết tủa Cu2O, còn C2H5OH không có phản ứng. Nếu dùng dung dịch Br2/CCl4, thì CH3CHO sẽ làm dung dịch mất màu do bị oxi hóa thành axit axetic, còn C2H5OH không có phản ứng.
2.3. Thực hiện phản ứng CH3CHO + H2 → C2H5OH như thế nào?
Để thực hiện phản ứng này, ta cần có các điều kiện sau:
– Nhiệt độ: khoảng 200°C
– Xúc tác: Ni (niken)
– Áp suất: cao
Cơ chế phản ứng có thể được mô tả như sau:
– Hidro phân ly thành các nguyên tử H trên bề mặt Ni.
– Nguyên tử H tác dụng với nhóm CHO của anđehit axetic, tạo ra nhóm CHOH.
– Nhóm CHOH bị tái cấu trúc thành nhóm OH, tạo ra ancol etylic.
Phương trình phản ứng có thể được viết như sau:
CH3CHO + H2 → C2H5OH
2.4. Phương trình ion của phản ứng CH3CHO + H2 → C2H5OH:
Phương trình ion của phản ứng CH3CHO + H2 → C2H5OH là phương trình biểu diễn các ion tham gia vào phản ứng hóa học. Phương trình ion có thể được viết bằng cách xác định các ion trong dung dịch phản ứng và viết chúng theo dạng ion. Trong trường hợp này, CH3CHO và C2H5OH là các phân tử không phân ly thành ion, do đó chúng được viết theo dạng phân tử. H2 là một khí không tan trong nước, do đó nó cũng được viết theo dạng phân tử. Phương trình ion của phản ứng là:
CH3CHO + H2 → C2H5OH
Phương trình này cho thấy rằng không có sự thay đổi về số lượng và loại ion trong dung dịch phản ứng. Do đó, phản ứng này là một phản ứng không thay đổi ion, tức là không có sự tạo thành kết tủa, khí hoặc axit yếu hay bazơ yếu.
2.5. Cân bằng phương trình CH3CHO + H2 → C2H5OH:
Để cân bằng phương trình CH3CHO + H2 → C2H5OH, ta có thể sử dụng phương pháp định luật bảo toàn nguyên tố. Theo đó, ta cần đảm bảo số nguyên tử của mỗi nguyên tố ở hai vế của phương trình bằng nhau. Ta có thể làm như sau:
– Bước 1: Ghi số nguyên tử của mỗi nguyên tố ở hai vế của phương trình:
Nguyên tố | Vế trái | Vế phảii |
C | 2 | 2 |
H | 6 | 6 |
O | 1 | 1 |
– Bước 2: Kiểm tra xem có nguyên tố nào chưa cân bằng không. Nếu có, ta thêm hệ số cho chất chứa nguyên tố đó để cân bằng. Nếu không, ta chuyển sang bước cuối cùng.
Trong trường hợp này, ta thấy rằng tất cả các nguyên tố đều đã cân bằng, nên ta không cần thêm hệ số nào.
– Bước 3: Viết lại phương trình với các hệ số đã tìm được (nếu có). Đây là phương trình đã cân bằng.
CH3CHO + H2 → C2H5OH
Đây là cách cân bằng phương trình CH3CHO + H2 → C2H5OH một cách đơn giản và chính xác.
2.6. Ứng dụng của Phản ứng CH3CHO + H2 → C2H5OH:
Phản ứng CH3CHO + H2 → C2H5OH là một phản ứng cộng hidro, trong đó formaldehyd (CH3CHO) tác động với hidro (H2) để tạo ra etanol (C2H5OH). Dưới đây là một số ứng dụng của phản ứng này:
– Sản xuất etanol: Phản ứng này là một phương pháp tổng hợp etanol, một loại cồn được sử dụng rộng rãi trong công nghiệp và ngành y tế. Etanol có thể được sử dụng làm nhiên liệu, dung môi, chất khử trùng và nguyên liệu trong sản xuất các sản phẩm hóa học khác.
– Nhiên liệu sinh học: Etanol là một loại nhiên liệu sinh học quan trọng, được sử dụng trong ngành công nghiệp nhiên liệu sinh học. Phản ứng CH3CHO + H2 → C2H5OH cung cấp một phương pháp chế tạo etanol từ formaldehyd và hidro, làm tăng nguồn cung cấp nhiên liệu sinh học thân thiện với môi trường.
– Sản xuất hóa chất: Etanol có thể được sử dụng làm chất gốc để sản xuất nhiều loại hợp chất hữu cơ khác, như xeton, este và axit axetic. Các hợp chất này được sử dụng rộng rãi trong ngành công nghiệp hóa chất.
– Dung môi: Etanol là một dung môi phổ biến trong nhiều ứng dụng khác nhau. Nó có thể được sử dụng làm dung môi trong công nghiệp sơn, mực in, mỹ phẩm và sản xuất dược phẩm.
– Ngành y tế: Etanol được sử dụng trong ngành y tế như một dung dịch khử trùng và chất tẩy trang trước tiêm. Nó cũng được sử dụng để sản xuất các loại thuốc và chất dùng trong y học.
3. Bài tập vận dụng liên quan:
Câu 1: Công thức phân tử của ancol C4H10O có bao nhiêu công thức cấu tạo khác nhau?
A. 1
B. 2
C. 3
D. 4
Câu 2: Công thức cấu tạo của rượu etylic là
A. CH2 – CH3 – OH.
B. CH3 – O – CH3.
C. CH2 – CH2 – OH2.
D. CH3 – CH2 – OH.
Câu 3: Từ ancol etylic người ta có thể điều chế được sản phẩm nào sau đây?
A. Axit axetic
B. Cao su tổng hợp
C. Etyl axetat
D. Cả ba đáp án trên đều đúng
Câu 4: Ancol etylic có khả năng tan tốt trong nước là do
A. Ancol etylic tạo được liên kết hidro với nước
B. Ancol etylic uống được
C. Ancol etylic là chất lỏng
D. Ancol etylic chứa cacbon và hidro
Câu 5: Trong 100ml rượu 40° có chứa
A. 40 ml nước và 60 ml rượu nguyên chất.
B. 40 ml rượu nguyên chất và 60 ml nước.
C. 40 gam rượu nguyên chất và 60 gam nước.
D. 40 gam nước và 60 gam rượu nguyên chất.
Câu 6: Cho các nhận định dưới đây, nhận định đúng là
(a) Anđehit là hợp chất chỉ có tính khử.
(b) Anđehit cộng H2 thành ancol bậc một.
(c) Anđehit tác dụng với AgNO3/NH3 tạo thành Ag.
(d) Anđehit no, đơn chức, mạch hở có công thức tổng quát CnH2nO.
A. (c), (d)
B. (b), (c), (d)
C. (b), (c)
D. (a), (d), (e)
4. Hướng dẫn lời giải:
Câu 1:
Đáp án: D. 4
CH3-CH2-CH2-CH2-OH
CH3-CH2-CH(OH)-CH3
CH3-CH(CH3)-CH2-OH
CH3-CH(OH)(CH3)-CH3
Có tất cả 4
Câu 2:
Đáp án: D. CH3 – CH2 – OH.
Câu 3:
Đáp án: C. Etyl axetat.
Câu 4:
Đáp án: A. Ancol etylic tạo được liên kết hidro với nước.
Câu 5:
Đáp án: B. 40ml rượu nguyên chất và 40 ml nước.
Câu 6:
Đáp án: B. (b), (c), (d)
(a) sai, anđehit là hợp chất vừa có tính oxi hóa và tính khử.
(b) đúng
(c) đúng
(d) sai, vì Anđehit no, đơn chức, mạch hở có công thức tổng quát là CnH2nO
(e) sai, anđehit no vẫn có phản ứng cộng vào nhóm -CHO
Vậy có 2 phát biểu đúng.