Đồng (II) oxide là oxide của đồng, thường tồn tại trong tự nhiên dưới dạng bột màu đen với công thức hoá học là CuO. Vậy cân bằng phương trình hoá học: CuO + CO → Cu + CO2 như thế nào, mời các bạn cùng tham khảo bài viết dưới đây để có cái nhìn tổng quan về phương trình hóa học trên.
Mục lục bài viết
1. Cân bằng phương trình hoá học: CuO + CO → Cu + CO2:
Phản ứng CuO + CO hay CuO ra Cu hoặc CO ra Cu hoặc CO ra CO2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về CuO có lời giải, mời các bạn đón xem:
CuO + CO → Cu + CO2
– Điều kiện phản ứng: Nhiệt độ cao.
– Cách thực hiện phản ứng: Cho dòng khí CO đi qua bột CuO màu đen.
– Hiện tượng nhận biết phản ứng: Bột CuO màu đen chuyển dần sang màu đỏ gạch là Cu.
– Bạn có biết: Tương tự các oxit bazơ đứng sau oxit nhôm trong dãy hoạt động hóa học (như FeO, PbO….) bị khử bởi CO tạo thành kim loại và khí CO2.
2. Tìm hiểu về Đồng (II) oxide:
Đồng (II) oxide là oxide của đồng, thường tồn tại trong tự nhiên dưới dạng bột màu đen với công thức hoá học là CuO.
Tên gọi theo danh pháp IUPAC: Copper(II) oxide
Chất này còn có các tên gọi khác như: Cupric oxide, Đồng monoxide, Đồng oxide, Cuprum(II) oxide, Cuprum monoxide, Cuprum oxide,… ứng dụng trong sản xuất vật liệu siêu dẫn, gốm sứ, thủy tinh, dệt nhuộm…
Tính chất vật lý:
– Cảm quan: Tồn tại dưới dạng dạng bột màu đen.
– Khối lượng phân tử: 79,5454 g/mol.
– Trọng lượng riêng: 6,31 g/cm3.
– Nhiệt độ nóng chảy: 1.201 °C tương ứng với 1.474 K hoặc 2.194 °F.
– Độ tan:
+ Không tan trong nước.
+ Tan trong dung dịch axit, amoniac, amoni clorua.
– Không bắt lửa
Tính chất hóa học:
– Phản ứng với dung dịch axit: Sản phẩm tạo thành là muối đồng và nước:
CuO + 2HCl → CuCl2 + H2O
– Phản ứng với hợp chất oxit axit: Sản phẩm tạo thành muối:
3CuO + P2O5 → Cu3(PO4)2
– Bị khử trong điều kiện nhiệt độ cao:
H2 + CuO → Cu + H2O
Ứng dụng của CuO trong đời sống:
– Sản xuất gốm sứ: Trong sản xuất gốm sứ, nó được sử dụng làm chất tạo màu, cho màu xanh lá. Bởi vì trong môi trường oxi hoá thông thường, CuO không bị khử thành Cu2O. Ngoài ra, CuO còn là 1 flux khá mạnh, giúp làm tăng độ chảy của men nung và tăng phản ứng cracking do hệ số giãn nở nhiệt cao. Khi kết hợp với Ti2O5 sẽ tạo ra hiệu quả “blotching” và “specking” rất đẹp. Còn khi kết hợp với thiếc hoặc zirconi sẽ cho màu turquoise hay blue-green trong men kiềm thổ. Nếu cho CuO vào men bari, thiếc hoặc natri sẽ có màu xanh lam. Tuy nhiên K2O có thể làm cho men của CuO chuyển sang màu vàng.
– Chất xúc tác: Trong các phản ứng hoá học, CuO được thêm vào với vai trò là chất xúc tác. Đồng thời nó cũng được sử dụng để làm sạch khí Hydrogen và làm vật liệu siêu dẫn hiện nay.
– Sản xuất mạch bảng: Trong các bảng mạch mạ, mạ điện oxide đồng được sử dụng là nguồn bổ sung liên tục cho bản mạch PCB. Đây là nguyên liệu để làm chất tạo màu và vật liệu từ tính. Ngoài ra, nó còn được sử dụng trong sản xuất màng cho pin mặt trời, khử lưu huỳnh, khử nitrat, sản xuất pháo hoa, thuốc nhuộm,…
CuO có độc không? Những lưu ý khi sử dụng CuO?
CuO là hoá chất được sử dụng rộng rãi trong nhiều lĩnh vực của đời sống nhưng vẫn có thể gây độc cho con người khi tiếp xúc hoặc hít phải, đặc biệt là những người phải thường xuyên tiếp xúc. Vì vậy, cần lưu ý một số điều sau trong quá trình thực hiện:
– Chuẩn bị và mang đầy đủ đồ bảo hộ như găng tay, kính mắt, khẩu trang,… để đảm bảo an toàn và hạn chế tiếp xúc trực tiếp với các hoá chất.
– Nếu chẳng may bị dính hoặc hít phải tiến hành sơ cứu rồi đến cơ sở y tế gần nhất để được thăm khám.
– Bảo quản hóa chất ở nơi khô ráo, thoáng mát, tránh ánh nắng mặt trời chiếu vào hay nơi có độ ẩm cao vì có thể ảnh hưởng đến chất lượng của sản phẩm.
3. Bài tập vận dụng kèm đáp án:
Ví dụ 1: Cho luồng khí CO dư qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm ?
A. Cu, Fe, Al, Mg.
B. Cu, FeO, Al2O3, MgO.
C. Cu, Fe, Al2O3, MgO.
D. Cu, Fe, Al, MgO
Đáp án C
Hướng dẫn giải:
Vì CuO, Fe2O3 đứng sau oxit nhôm bị khử bởi CO tạo thành các kim loại Cu, Fe và H2O. Còn Al2O3 và MgO là không bị khử bởi H2.
Ví dụ 2: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là:
A. 0,8 gam. B. 8,3 gam.
C. 2,0 gam. D. 4,0 gam.
Đáp án D
Hướng dẫn giải:
Gọi nCuO = x mol
CuO + CO → Cu + CO2
x mol x mol x mol x mol
Áp dụng định luật bảo toàn khối lượng
mhỗn hợp oxit + mCO = mchất rắn + mCO2
9,1 + 28x = 8,3 + 44x ⇒ x = 0,05 mol ⇒ mCuO = 0,05. 80 = 4 g
Ví dụ 3: Khử 16 gam hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO và PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 gam. Thể tích khí CO đã tham gia phản ứng (đktc) là
A. 2,24l B. 3,36l
C. 4,48l D. 6,72l
Đáp án D
Hướng dẫn giải:
Áp dung ĐLBT khối lượng
nCO2 = nCO = x mol
moxit + mCO = mchất rắn + mCO2
28x – 44x = 11,2 – 16 ⇒ x = 0,3.
Vậy VCO = 0,3. 22,4 = 6,72 lit
Ví dụ 4: Phản ứng nào trong các phản ứng sau đây, cacbon thể hiện tính oxi hóa ?
A. C + O2 → CO2
B. C + 2CuO → 2Cu + CO2
C. 3C + 4Al → Al4C3
D. C + H2O → CO + H2
Đáp án C
Hướng dẫn giải:
Vì C có số OXH giảm.
Ví dụ 5: Trộn 20 gam bột CuO và một lượng C rồi đem nung. Sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng CuO còn lại không bị khử là
A. 4g B. 8g
C. 12g D. 16g
Đáp án B
Hướng dẫn giải:
CuO + C → Cu + CO
nCO = 3,36/22,4 = 0,15 mol → nCuO phản ứng = 0,15 mol ⇒ mCuO phản ứng = 12 gam.
⇒ mCuO còn lại = 8 gam.
Ví dụ 6: Cho các oxit Fe2O3, MgO, CuO, BaO. Số oxit bị C khử ở nhiệt độ cao là
A. 1 B. 2
C. 3 D.4
Đáp án B
Ví dụ 7: Dẫn một lượng dư khí CO qua hỗn hợp Al2O3, MgO, Fe2O3, CuO nung nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, MgO, Fe, Cu.
B. Al, Fe, Cu, Mg.
C. Al2O3, Mg, Fe, Cu.
D. Al2O3, MgO, Fe3O4, Cu.
Hướng dẫn giải:
Đáp án A
Có hai phản ứng xảy ra:
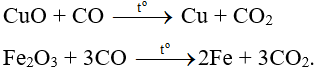
Ví dụ 8: Đun nóng hỗn hợp gồm bột CuO và C. Sản phẩm khí sinh ra được dẫn qua bình đựng nước vôi trong thì thấy khối lượng bình tăng lên 5,5 gam. Khối lượng Cu tạo thành và khối lượng C tham gia phản ứng là
A. 10 gam Cu và 1,5 gam C.
B. 16 gam Cu và 2 gam C.
C. 16 gam Cu và 1,5 gam C.
D. 12 gam Cu và 3 gam C.
Lời giải:
Đáp án C
![]()
Bình đựng Ca(OH)2 hấp thụ nước vôi trong, nên khối lượng bình tăng chính là khối lượng của CO2.
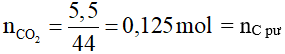
Vậy mC pư = 0,125.12 = 1,5 gam → loại đáp án B và D.
Lại có nCu = 2nC = 0,25 mol; vậy mCu = 0,25.64 = 16 gam.
Ví dụ 9. Nung nóng 29 gam oxit sắt với khí CO dư, sau khi phản ứng xảy ra hoàn toàn khối lượng chất rắn còn lại là 21 gam. Công thức oxit sắt là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. FeO hoặc Fe3O4.
Hướng dẫn giải
Đáp án B
Đặt nCO pư = a mol
Vì lượng CO dư và phản ứng xảy ra hoàn toàn nên chất rắn chỉ chứa Fe.
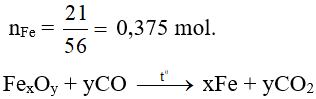
a ….………………a mol
Bảo toàn khối lượng: moxit + mCO pư = mFe + mCO2
→ 29 + 28a = 44a + 21 a = 0,5 mol = nO (oxit)
→ nFe : nO = 0,375 : 0,5 = 3:4.
Vậy công thức của oxit sắt là Fe3O4.




