Phương pháp bảo toàn nguyên tố trong hóa học được áp dụng dựa trên nguyên lý bảo toàn khối lượng, có nghĩa là trong một phản ứng hóa học, tổng khối lượng của các chất tham gia phản ứng phải bằng tổng khối lượng của các sản phẩm phản ứng.
Mục lục bài viết
1. Các phương pháp bảo toàn nguyên tố trong hóa học:
Các phương pháp bảo toàn nguyên tố trong hóa học là một phần cực kỳ quan trọng của những nguyên tắc cơ bản của hóa học. Một trong những nguyên tắc quan trọng nhất đó là “phương trình hoá học phải bảo toàn nguyên tố”. Điều này có nghĩa là trong một phản ứng hóa học, tổng số mol nguyên tử của mỗi nguyên tố trước và sau phản ứng phải luôn bằng nhau.
Ví dụ, khi xem xét phản ứng đơn giản như phản ứng của kim loại sắt với oxit sắt(III):
Trong phản ứng này, tổng số mol nguyên tử của sắt trước phản ứng (1 mol) phải bằng tổng số mol nguyên tử của sắt sau phản ứng (2 mol). Điều này làm nổi bật tính chất bảo toàn nguyên tố trong hóa học.
Phạm vi sử dụng của nguyên lý này rất rộng lớn. Nó áp dụng không chỉ trong những phản ứng đơn giản mà còn trong những phản ứng phức tạp, đặc biệt là trong việc giải các dạng bài tập đòi hỏi áp dụng nguyên tắc bảo toàn nguyên tố.
Ví dụ, khi có một bài tập yêu cầu xác định số mol của các chất ban đầu hoặc sản phẩm trong một phản ứng hóa học, chúng ta có thể sử dụng phương pháp bảo toàn nguyên tố. Bằng cách phân tích các thông tin đã cho trong đề bài, chúng ta có thể áp dụng nguyên lý bảo toàn nguyên tố để xác định số mol của các chất cần tìm.
Đối với các phản ứng tạo ra nhiều sản phẩm từ một chất ban đầu, ta cũng có thể áp dụng nguyên lý này để xác định số mol của các chất cần tìm.
Nhờ vào nguyên tắc bảo toàn nguyên tố, chúng ta có thể giải quyết hiệu quả các bài toán phức tạp trong hóa học, từ những phản ứng đơn giản đến những phản ứng phức tạp và hỗn hợp nhiều chất.
Đối với dạng bài này không cần thiết phải tìm chính xác số mol của từng chất, chỉ quan tâm: ![]() (chỉ quan tâm đến tổng số mol của các nguyên tố trước và sau phản ứng)
(chỉ quan tâm đến tổng số mol của các nguyên tố trước và sau phản ứng)
+ Đốt cháy để phân tích thành phần nguyên tố của hợp chất
Chú ý:
+ Hạn chế viết phương trình phản ứng mà viết sơ đồ phản ứng biểu diễn sự biến đổi của nguyên tố đang cần quan tâm
+ Từ số mol của nguyên tố chúng ta quan tâm sẽ tính ra được số mol của các chất
+ Số mol nguyên tố trong hợp chất bằng số nguyên tử của nguyên tố đó trong hợp chất nhân với số mol hợp chất chứa nguyên tố đó
Giả sử ta có hợp chất AxBy có số mol là a (mol).
Khi đó số mol nguyên tố A và B trong hợp chất là: 
2. Ví dụ minh họa:
Ví dụ 1: Từ 6,2 gam photpho điều chế được bao nhiêu lít dung dịch H3PO4 2M (hiệu suất toàn bộ quá trình phản ứng là 80%).
A. 100 lít.
B. 80 lít.
C. 40 lít.
D. 64 lít.
Giải:
+ Nhận thấy lượng P ban đầu được bảo toàn thành P trong HNO3 80% vì hiệu suất cả quá trình điều chế là 80%.

⇒ Đáp án B.
Ví dụ 2: Đốt cháy 4,16 gam hỗn hợp Mg và Fe trong khí O2, thu được 5,92 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
A. 32,65.
B. 31,57.
C. 32,11.
D. 10,80.
Giải:

+ Tương tự như trên ta cần phải tính được nAg, nung Z thu được oxit có m = 6g > mX(5,92g)
⇒ Trong X phải có FeO,
Do đó khối lượng O dùng để oxi hóa Fe2+ trong X thành Fe3+ là:

⇒ Đáp án A
Ví dụ 3: Một hỗn hợp A gồm anđehit acrylic và một anđehit no, đơn chức X. Đốt cháy hoàn toàn 3,44 gam hỗn hợp trên cần vừa hết 4,592 lít khí oxi (đktc). Cho toàn bộ sản phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thu được 17 gam kết tủa. Công thức cấu tạo của X là:
A.CH2O.
B.C2H4O.
C.C3H6O.
D.C4H8O.
Giải
Trước hết ta tính được tất cả những gì có thể tính được ngay:

Bảo toàn khối lượng:

Anđehit đơn chức ⇒ do đó nA = nO(trong A)
+ Áp dụng định luật bảo toàn nguyên tố O, ta được:

Vì anđehit acrylic CH2 = CH – CHO có phân tử khối là 56 nên suy ra được X < 49,14 ⇒ loại ngay đáp án C và D.
+ Vì X là anđehit no đơn chức nên có dạng CnH2nO ⇒ nCO2 = nH2O
Vì anđehit acrylic là anđehit có một nối đôi, đơn chức có công thức là C3H4O

Ví dụ 4: Hấp thụ hoàn toàn 2,24 lít (đktc) CO2 vào 100ml dung dịch gồm K2CO3 0,2 M và KOH x mol/lít. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa. Giá trị X là:
A, 1,0.
B. 1,4.
C. 1,2.
D. 1,6.
Giải:

Ví dụ 5: Trong một bình kín chứa 3,5 mol hỗn hợp gồm H2, một amin đơn chức và 4 mol O2. Bật tia lửa điện để đốt cháy hoàn toàn hỗn hợp. Thu được 1 mol CO2; 0,5 mol N2; 0,5 mol O2 và a mol H2O. Công thức phân tử của amin là:
A. CH5N.
B. C3H6N.
C. C3H5N.
D. C2H7.
Giải:
Bảo toàn nguyên tố O

Do đó công thức của amin là CH5N ⇒ Đáp án A
3. Bài tập tự luyện:
Bài 1: Đốt cháy 9,8g bột Fe trong không khí thu được hỗn hợp rắn X gồm FeO, Fe3O4 và Fe2O3. Để hòa tan X cần dùng vừa hết 500ml dung dịch HNO3 1,6M, thu được V lít khí NO ( sản phẩm khử duy nhất). Gía trị của V là:
A. 6,16
B. 10,08
C. 11,76
D. 14,0
Lời giải:
Bảo toàn nguyên tố Fe: nFe(NO3)3 = nFe = 0,175 mol
Bảo toàn nguyên tố N:
nNO = nHNO3 – 3nFe(NO3)3 = 0,5.16 – 3.0,175 = 0,275 mol
⇒ V = 0,275.22,4 = 6,16 lít ⇒Đáp án A
Bài 2: Hỗn hợp X gồm C3H6, C4H10, C2H2 và H2. Cho m gam X vào bình kín có chứa một ít Ni làm xúc tác. Nung bình được hỗn hợp Y. Đốt cháy hoàn toàn Y cần V lít O2 (đktc), sản phẩm hấp thụ vào bình đựng nước vôi trong dư thu được dung dịch có khối lượng giảm 21,45 gam. Nếu Y đi qua bình đựng lượng dư dung dịch brom trong CCl4 thì có 24 gam brom phản ứng. Mặt khác, 11,2 lít hỗn hợp X đi qua bình đựng dung dịch brom dư trong CCl4 thấy có 64 gam brom phản ứng. Tìm V?
Lời giải:
Theo giả thiết, Y phản ứng được với dung dịch brom trong CCl4. Do đó trong Y còn hidrocacbon không no và H2 phản ứng hết.
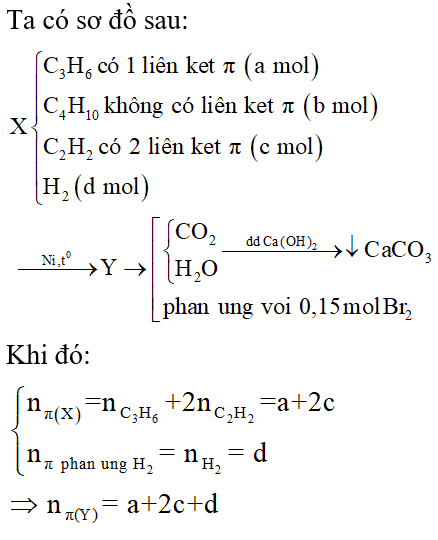

Trong đó k là tỉ lệ giữa hỗn hợp X cho tác dụng với dung dịch brom và hỗn hợp X đem đốt cháy.


Bài 3: Một hỗn hợp gồm Al2(SO4)3 và K2SO4, trong đó Số nguyên tử oxi chiếm 20/31 tổng số nguyên tử có trong hỗn hợp. Hoà tan hỗn hợp trên vào nước rồi cho tác dụng với dung dịch BaCl2 dư, hỏi khối lượng kết tủa thu được gấp bao nhiêu lần khối lượng hỗn hợp ban đầu:
A. 1,788 lần.
B. 1,488 lần.
C. 1,688 lần.
D. 1,588 lần.
Lời giải:
Gọi 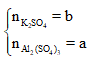
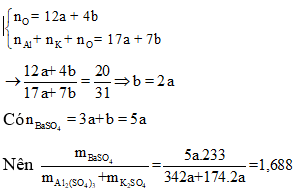
⇒ Đáp án C
Bài 4: Hỗn hợp X gồm 1 ancol và 2 sản phẩm hợp nước của propen. Tỉ khối hơi của X so với hiđro bằng 23. Cho m gam X đi qua ống sứ đựng CuO (dư) nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y gồm 3 chất hữu cơ và hơi nước, khối lượng ống sứ giảm 3,2 gam. Cho Y tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, tạo ra 48,6g Ag. Phần trăm khối lượng của propan-l-ol trong X là:
A. 65,2%:
B. 16,3%.
C. 48,9%.
D. 34,5%.
Lời giải:
X gồm ROH và CH3CH2CH2OH, (CH3)2CHOH.
Có M (trung bình)X = 23.2 = 46
Mà CH3CH2CH2OH và (CH3)2CHOH có M = 60 > 46 nên ROH là CH3OH
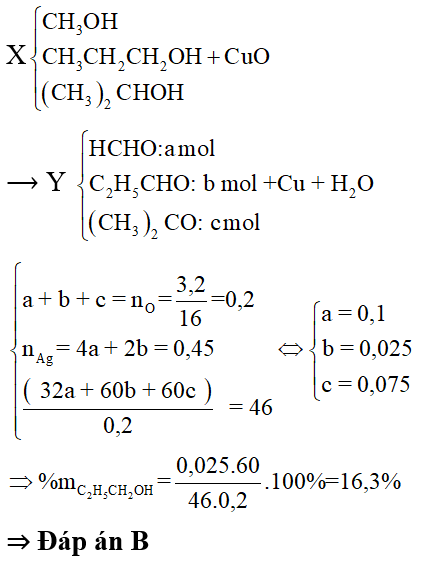
Bài 5: Cho 46,6 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 30,9% về khối lượng) tan hết vào nước thu được dung dịch Y và 8,96 lít H2 (đktc). Cho 3,1 lít dung dịch HC1 0,5M vào dung dịch Y thu được m gam kết tủa. Giá trị của m là:
A. 7,8.
B. 35,1.
C. 27,3.
D. 0.
Lời giải:
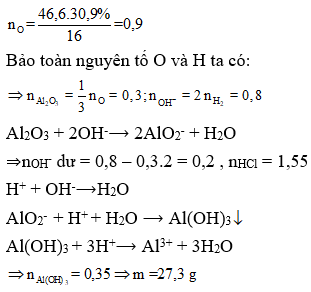
⇒ Đáp án C
Bài 6: Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai este đồng phân cần dùng 27,44 lít khí O2 thu được 23,52 lít khí CO2 và 18,9 gam H2O. Nếu cho m gam X tác dụng hết với 400 ml dung dịch NaOH 2M, cô cạn dung dịch sau phản ứng thì thu được 27,9 gam chất rắn khan, trong đó có a mol muối Y và b mol muối Z (My < Mz). Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Tỉ lệ a : b là
A. 2:3.
B. 3 : 5.
C. 4 : 3.
D. 3 : 2.
Lời giải:
⇒ Công thức chung của X có dạng CnH2nO2
Bảo toàn nguyên tố O:
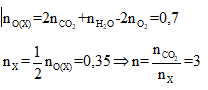
Do đó X gồm HCOOC2H5: a mol và CH3COOCH3: b mol với a + b = 0,35 (1)
27,9 gam chất rắn khan chứa 0,05 mol NaOH dư nên 68a + 82b + 0,05.40 = 27,9 (2)
Từ (1) và(2) có a = 0,2 và b = 0,15⇒ a : b = 4 : 3 ⇒ Đáp án C
Bài 7: Cho 6,44 gam một ancol đơn chức phản ứng với CuO đun nóng, thu được 8,68 gam hỗn hợp X gồm anđehit, nước và ancol dư. Cho toàn bộ X tác dụng với lượng dư dung dịch AgNO3 trong NH3, kết thúc các phản ứng thu được m gam Ag. Giá trị của m là
A.30,24.
B. 86,94.
C. 60,48.
D. 43,47.
Bài 8: Hòa tan m gam hỗn hợp X gồm FeO, Fe(OH)2, Fe(OH)3 ( ) trong dung dịch HNO3 vừa đủ thu được dung dịch Y và khí NO (sản phẩm khử duy nhất, đktc). Cô cạn dung dịch Y và lấy chất rắn thu được nung đến khối lượng không đổi thu được 30,4 gam chất rắn khan. Nếu cho 11,2 gam Fe vào dung dịch Y thu được dung dịch Z và p gam chất rắn không tan. p có giá trị là
A.0,84 g.
B. 0,56 g.
C. 0,28 g.
D. 1,12 g.
Lời giải:
Bảo toàn nguyên tố Oxi:
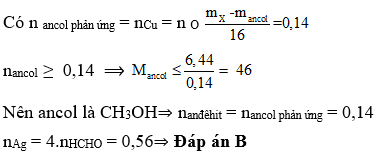
Bài 9: Phân supephotphat kép thực tế sản xuất được thường chỉ có 40% P2O5. Hàm lượng Ca(H2PO4)2 trong phân bón đó là
A. 56,94%.
B. 65,92%.
C. 78,56%.
D. 75,83%.
Lời giải:
Phân supephotphat kép gồm Ca(H2PO4)2 và CaSO4

Bài 10: Hỗn hợp X gồm axit fomic, axit acrylic, axit oxalic và axit axetic . Cho m gam X phản ứng hết với dung dịch NaHCO3 thu được 0,672 lít CO2 (đktc). Đốt cháy hoàn toàn m gam X cần 1,008 lít O2 (đktc), thu được 2,42 gam CO2 và a gam H2O. Giá trị của a là
A. 1,80.
B. 0,72.
C. 1,44.
D. 1,62
Lời giải:
Nhận thấy: Cứ 1 nhóm -COOH phản ứng với NaHCO3 tạo 1 phân tử CO2
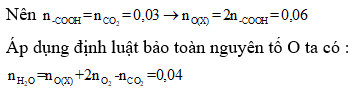
⇒a = 18.0,04 = 0,72(gam) ⇒ Đáp án B




