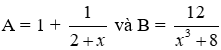Những công thức giải nhanh các bài trắc nghiệm hoá học là những công thức đã được rút gọn, tinh giản đến mức tối đa để giúp học sinh áp dụng và tìm ra đáp án. Dưới đây là những công thức giải nhanh trắc nghiệm hóa học cực hay, mời các bạn cùng tham khảo.
Mục lục bài viết
1. Công thức giải nhanh các bài trắc nghiệm hoá học là gì?
Những công thức giải nhanh các bài trắc nghiệm hoá học là những công thức đã được rút gọn, tinh giản đến mức tối đa để giúp học sinh áp dụng và tìm ra đáp án, kết quả ngay lập tức hoặc tiến gần tới đáp án chính xác nhất có thể.
Cách giải nhanh này không chỉ giúp học sinh tiết kiệm thời gian mà còn giúp họ hiểu sâu hơn về các khái niệm và nguyên tắc cơ bản trong hoá học. Thông qua việc áp dụng những công thức giải nhanh này, học sinh có thể nhận biết và phân loại các loại phản ứng hóa học, tính toán các giá trị số liệu cơ bản, và giải quyết các vấn đề liên quan đến thế hệ năng lượng trong các phản ứng hóa học.
Cách giải nhanh cũng giúp học sinh phát triển kỹ năng tư duy logic và phân tích trong việc giải quyết các bài tập trắc nghiệm hoá học. Bằng cách hiểu rõ các qui tắc và quy định, học sinh có thể dễ dàng áp dụng chúng vào việc giải quyết các bài tập khó hơn và tìm ra câu trả lời chính xác một cách nhanh chóng.
Cách giải nhanh đã được phát triển và truyền đạt qua nhiều thế hệ học sinh trước đây, và ngày nay, nó ngày càng trở nên phổ biến trong các đề thi trắc nghiệm hoá học. Việc nắm vững và áp dụng thành thạo các công thức giải nhanh này sẽ giúp học sinh nâng cao hiệu suất học tập và đạt kết quả tốt trong môn hóa học.
2. Các công thức giải nhanh trắc nghiệm hóa học phần hữu cơ:
1. Tính hiệu suất phản ứng hiđro hoá anken:
Tiến hành phản ứng hiđro hóa anken CnH2n từ hỗn hợp X gồm anken CnH2n và H2 (tỉ lệ 1:1) được hỗn hợp Y thì hiệu suất hiđro hoá là:

2. Tính hiệu suất phản ứng hiđro hóa anđehit đơn chức no:
Tiến hành phản ứng hiđro hóa anđehit đơn chức no CnH2nO từ hỗn hợp hơi X gồm anđehit CnH2nO và H2 (tỉ lệ 1:1) được hỗn hợp hơi Y thì hiệu suất hiđro hoá là:

3. Tính % ankan A tham gia phản ứng tách (bao gồm phản ứng đề hiđro hoá ankan và phản ứng cracking ankan:
Tiến hành phản ứng tách ankan A, công thức C2H2n+2 được hỗn hợp X gồm H2 và các hiđrocacbon thì % ankan A đã phản ứng là:

Lưu ý:
Công thức trên vẫn đúng nếu hỗn hợp X không có mặt H2 mà chỉ gồm các hiđrocacbon.
4. Xác định công thức phân tử ankan A dựa vào phản ứng tách của A:
Tiến hành phản ứng tách V(l) hơi ankan A, công thức C2H2n+2 được V’ hơi hỗn hợp X gồm H2 và các hiđrocacbon thì ta có:

Lưu ý: Công thức trên luôn đúng dù phản ứng tách có xảy ra hoàn toàn hay không, hoặc hỗn hợp X không có mặt H2 mà chỉ gồm các hiđrocacbon.
5. Tính số đồng phân ancol đơn chức no:
![]()
Điều kiện: 1 < n < 6
6. Tính số đồng phân anđehit đơn chức no:
![]()
Điều kiện: 2 < n < 7
7. Tính số đồng phân axit cacboxylic đơn chức no:
![]()
Điều kiện: 2 < n < 7
8. Tính số đồng phân este đơn chức no:
![]()
Điều kiện: 1 < n < 5
9. Tính số ete đơn chức no:

Điều kiện: 2 < n < 6
10. Tính số đồng phân xeton đơn chức no:

Điều kiện: 2 < n < 7
11. Tính số đồng phân amin đơn chức no:
![]()
Điều kiện: n < 5
12. Tính số C của ancol no hoặc ankan dựa vào phản ứng cháy:

13. Tìm công thức phân tử ancol no, mạch hở dựa vào tỉ lệ mol giữa ancol và O2 trong phản ứng cháy:
Giả sử đốt cháy hoàn toàn 1 mol ancol no, mạch hở A, công thức CnH2n+2Ox cần k mol O2 thì ta có:

14. Tính khối lượng ancol đơn chức no (hoặc hỗn hợp ancol đơn chức no) theo khối lượng CO2 và khối lượng H2O:

Lưu ý:
Khối lượng ancol đơn chức (hoặc hỗn hợp ancol đơn chức no) còn được tính:
![]()
15. Tính số đi, tri, tetra …, n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
![]()
16. Tính số triglixerit tạo bởi gilxerol với các axit cacboxylic béo:

17. Tính số ete tạo bởi hỗn hợp n ancol đơn chức:

18. Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol HCl, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol NaOH:
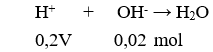
Lưu ý: (A): Amino axit (NH2)nR(COOH)m.
19. Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol NaOH, sau đó cho dung dịch sau phản ứng tác dụng vứa đủ với b mol HCl:
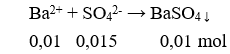
20. Tính số liên kết π của hợp chất hữu cơ mạch hở A, công thức CxHy hoặc CxHyOz dựa vào mối liên quan giữa số mol CO2; H2O thu được khi đốt cháy A:
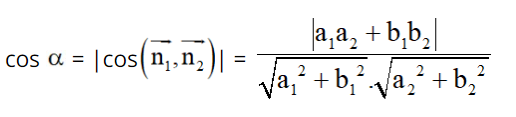
Lưu ý:
Hợp chất CxHyOzNtClu có số πmax = ![]() .
.
21. Xác định công thức phân tử của một anken dựa vào phân tử khối của hỗn hợp anken và H2 trước và sau khi dẫn qua bột Ni nung nóng:
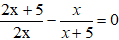
Lưu ý:
+ M1 là phân tử khối hỗn hợp anken và H2 ban đầu.
+ M2 là phân tử khối hỗn hợp sau phản ứng, không làm mất màu dd Br2.
+ Công thức của ankin dựa vào phản ứng hiđro hoá là:
3. Các công thức giải nhanh trắc nghiệm hóa học phần vô cơ:
1. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2
![]()
Lưu ý: Điều kiện áp dụng công thức: nkết tủa < nCO2.
2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
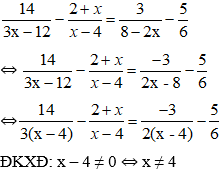
Lưu ý:
Điều kiện áp dụng công thức: nCO32- < nCO2
3. Tính VCO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
4. Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu:
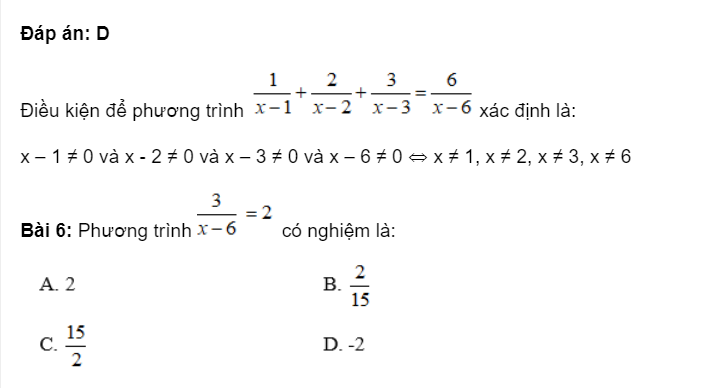
Lưu ý: Hai kết quả trên tương ứng với hai trường hợp NaOH dùng thiếu và NaOH dùng dư.
Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
5. Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu:
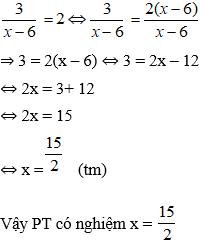
6. Tính Vdd NaOH cần cho vào dd Zn2+ để xuất hiện lượng kết tủa theo yêu cầu:
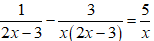
Lưu ý:
Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
7. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
![]()
8. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl giải phóng H2:
![]()
9. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
![]()
10. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl:
![]()
11. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ:
![]()
12. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
![]()
13. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
![]()
14. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
![]()
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
+) Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
+) Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
15. Tính số mol H2SO4 đặc, nóng cần dùng để hoà tan 1 hỗn hợp kim loại dựa theo sản phẩm khử SO2 duy nhất:
![]()
16. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):
![]()
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
17. Tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với HNO3 dư giải phóng khí NO:
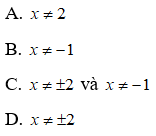
18. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng HNO3 đặc, nóng, dư giải phóng khí NO2:

Lưu ý:
+ Hỗn hợp không nhất thiết phải đủ bốn chất vẫn có thể áp dụng được công thức.
+ Dạng toán này, HNO3 phải dư để muối thu được là Fe (III). Không được nói HNO3 vừa đủ vì có thể phát sinh Fe dư khử Fe3+ về Fe2+:
+ Nếu giải phóng hỗn hợp NO và NO2 thì công thức là:
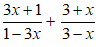
19. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc, nóng, dư giải phóng khí SO2:
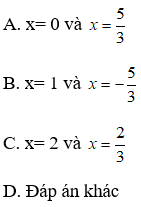
Lưu ý: Hỗn hợp không nhất thiết phải đủ 4 chất vẫn có thể áp dụng được công thức.
20. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO:
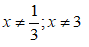
21. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO2:
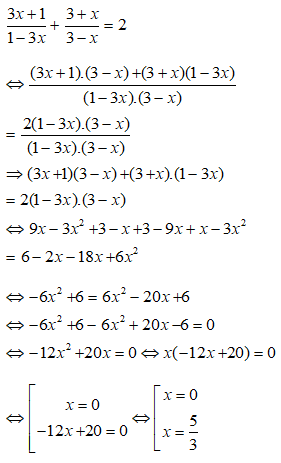
22. Tính VNO (hoặc NO2) thu được khi cho hỗn hợp sản phẩm sau phản ứng nhiệt nhôm (hoàn toàn hoặc không hoàn toàn) tác dụng với HNO3:
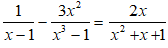
23. Tính pH của dd axit yếu HA:
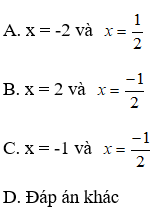
Lưu ý:
+) α là độ điện li
+) Công thức này đúng khi Ca không quá nhỏ (Ca ≥ 0, 01M)
24. Tính pH của dd hỗn hợp gồm axit yếu HA và muối NaA:
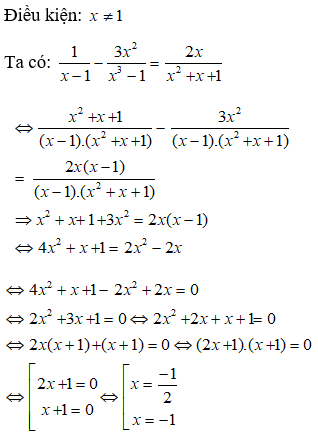
Lưu ý:
Dung dịch trên được gọi là dung dịch đệm.
25. Tính pH của dd bazơ yếu BOH:
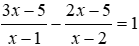
26. Tính hiệu suất phản ứng tổng hợp NH3:
Nếu tiến hành tổng hợp NH3 từ hỗn hợp gồm N2 và H2 với tỉ lệ mol tương ứng là 1:3 thì hiệu suất tổng hợp là:
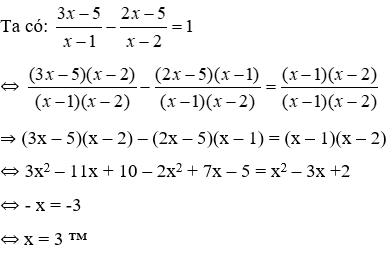
Với X là hỗn hợp ban đầu và Y là hỗn hợp sau.
27. Xác định kim loại M có hiđroxit lưỡng tính dựa vào phản ứng dd Mn+ với dd kiềm.
Dù M là kim loại nào trong các kim loại có hiđroxit lưỡng tính (Zn, Cr, Sn, Pb, Be) thì số mol OH- dùng để Mn+ kết tủa toàn bộ sau đó tan vừa hết cũng được tính là:
![]()
28. Xác định kim loại M có hiđroxit lưỡng tính dựa vào phản ứng dd Mn+ với dd MO2n-4 (hay [M(OH)4] n-4) với dd axit:
Dù M là kim loại nào trong các kim loại có hiđroxit lưỡng tính (Zn, Cr, Sn, Pb, Be) thì số mol H+ dùng để kết tủa M(OH)n xuất hiện tối đa sau đó tan vừa hết cũng được tính là:
![]()
29. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
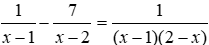
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
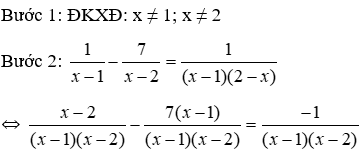
30. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
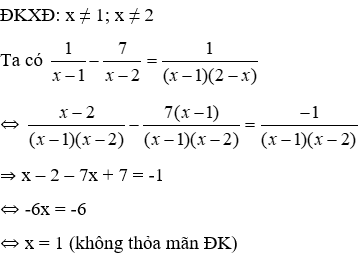
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất: