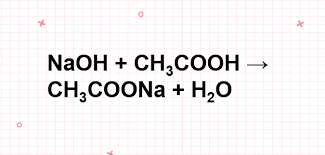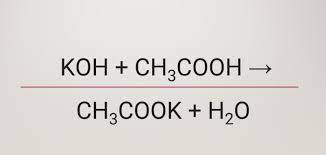Phản ứng C2H5OH + O2 hay C2H5OH ra CH3COOH thuộc loại phản ứng lên men, phản ứng oxi hóa khử đây cũng là phương pháp điều chế axit axetic trong nghiệp phổ biến nhất. Bài viết dưới đầy cung cấp một số thông tin về phản ứng hóa học này.
Mục lục bài viết
1. Tính chất của từng thành phần trong phản ứng:
Phương trình hóa học: C2H5OH + O2 → CH3COOH + H2O
1.1. Tính chất của C2H5OH:
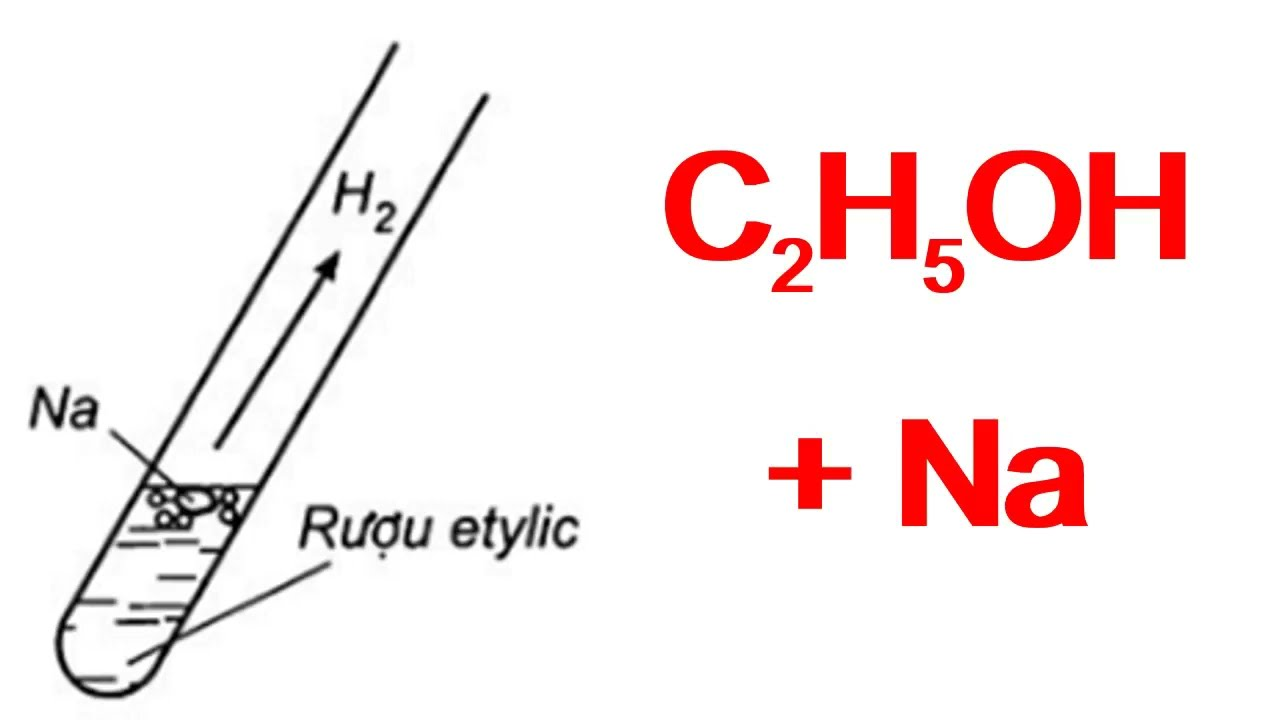
C2H5OH có tên gọi khoa học là ancol etylic hoặc etanol hay được biết với cái tên phổ biến là rượu etylic, rượu ngũ cốc. Etanol là một chất thuộc dãy đồng đẳng ancolhol, có công thức hóa học là C2H5OH hoặc C2H6O. Tồn tại ở dạng chất lỏng không màu, dễ cháy, là một trong các rượu thông thường có trong thành phần của đồ uống chứa cồn. Công thức phân tử của rượu ngũ cốc (ancol etylic) gồm có cacbon ở nhóm metyl (CH3-) liên kết với cacbon ở nhóm metylen (-CH2-), nhóm này liên kết với oxy của nhóm hydroxyl (-OH). Ở phân tử rượu Etylic có một nguyên tử H không liên kết với nguyên tử C mà liên kết với nguyên tử Oxi tạo ra nhóm – OH. Chính nhóm – OH này tạo nên đặc trưng riêng cho rượu ngũ cốc.
Ancol etylic được ứng dụng khá phổ biến ở nhiều lĩnh vực sản xuất:
Trong các ngành công nghiệp: Phần lớn Ancol Etylic sản xuất ra được sử dụng làm dung môi trong ngành công nghiệp nước hoa, dược phẩm, mỹ phẩm, in ấn, sơn, dệt may,… Người ta dùng C2H5OH trong các sản phẩm chống đông lạnh, dùng làm nhiên liệu thay xăng cho động cơ đốt trong. Cồn công nghiệp Ancol Etylic còn được dùng để làm nguyên liệu sản xuất các hợp chất hữu cơ khác như axit axetic, este,…
Trong ngành chế biến thực phẩm: C2H5OH được ứng dụng để sản xuất rượu, các loại đồ uống có cồng, ướp gia vị thực phẩm.
Trong ngành y tế: C2H5OH sử dụng để chống các loại vi sinh vật, vi khuẩn,… hoặc để sản xuất thuốc ngủ nhờ khả năng gây mê, gây buồn ngủ. Bên cạnh đó, nhờ đặc tính sát khuẩn cao của Ethanol nên cồn có nồng độ từ 70 đến 90 % thường được dùng để khử trùng các thiết bị, dụng cụ, các vết thương,..
Ancol Etylic trong ngành sản suất mỹ phẩm: Cồn Ethanol được dùng trong mỹ phẩm với vai trò giúp dưỡng da hoặc làm dung môi như cồn tốt được sử dụng trong điều chế mỹ phẩm với vai trò là chất giúp cân bằng độ ẩm, khiến cho da mềm mịn, không gây kích ứng. Tuy nhiên, đối với người có làn da mun, da dầu thì cồn béo lại không phải là sản phẩm phù hợp vì nó dễ gây bít tắc lỗ chân lông. Cồn khô, có khả năng chống khuẩn, khử trùng và phù hợp cho da nhờn giúp sạch da, hạn chế tiết dầu, không bít lỗ chân lông.
1.2. Tính chất của O2:
O2 có tên gọi là Oxy. Đây là nguyên tố hóa học phổ biến chiếm khối lượng lớn nhất trong vỏ Trái Đất. Ở dạng hợp chất nguyên tố oxi có trong đường, nước, quặng, đất đá, cơ thể người và động vật…Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng có 6e. Ở trong điều kiện bình thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hóa trị không cực có thể viết công thức cấu tạo phân tử oxi là O=O. Oxy tồn tại dưới dạng chất khí không màu, không mùi, không vị, nặng hơn không khí một ít. Oxi tan ít trong nước (ở 20 độ C, một lít nước chỉ hoà tan 31 ml oxi). Dưới áp suất của khí quyển, oxi hoá lỏng ở – 183 độ C. Oxi lỏng có màu xanh da trời, bị nam châm hút.
Oxy là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại cũng như hợp chất. Trong các hợp chất hóa học nguyên tố oxi có hóa trị II. Oxy tác dụng với rất nhiều kim loại (trừ kim loại vàng và bạch kim oxy không phản ứng). Phản ứng đặc trưng của oxy với kim loại là phản ứng cháy. Ở điều kiện bình thường hay điều kiện phức tạp thì hầu hết oxy đều phản ứng với kim loại để tạo ra các oxit . Đương nhiên, nếu ở điều kiện bình thường thì phản ứng sẽ xảy ra lâu hơn. Oxy cũng phản ứng trực tiếp với các phi kim, trừ nhóm halogen ( nhóm halogen gồm Flo, Clo, Brom, Iot và Atatin) tạo thành oxit axit hoặc tạo thành oxit không tạo muối. Có hai nguyên tố phi kim tác dụng với oxy được biết đến nhiều nhất là photpho (P) và lưu huỳnh(S).
Trong đời đống oxy có vai trò rất quan trọng, oxy quyết định sự sống của con người và động vật. Trong công nghiệp – đốt nhiên liệu oxy được ứng dụng nhiều bởi khi các nhiên liệu cháy trong oxi sẽ tạo nhiệt độ cao hơn khá nhiều so với cháy trong không khí. Ứng dụng dụng trong công nghiệp đốt nhiên liệu của oxi còn thể hiện qua hoạt động chế tạo mìn phá đá, oxi lỏng dùng để đốt nhiên liệu trong tên lửa. Một ứng dụng khá gần gũi của oxi trong công nghiệp luyện gang thép là thổi khí oxi để tạo nhiệt độ lớn hơn, nâng cao hiệu suất và chất lượng của gang và thép.
1.3. Tính chất của CH3COOH:
CH3COOH và công thức phân tử là C2H4O2 với tên gọi Axit axetic là một hợp chất hóa học có mặt trong rất nhiều ứng dụng của cuộc sống, đặc biệt là chế biến thực phẩm với tên gọi là “dấm ăn”. Axit axetic là một axit cacboxylic no có công thức hóa học là . Trong phân tử CH3COOH có một nhóm metyl liên kết với một nhóm cacboxyl. Axit axetic tồn tại dưới dạng chất lỏng không màu, vị chua và có mùi khá hăng. Ngoài ra, do gốc O-H của axit axetic phân cực mạnh hơn của ROH (ancol) nên khả năng tạo liên kết hydro cũng lớn hơn của alcohol. Nhiệt độ sôi của các chất có cùng phân tử khối với axit axetic được sắp xếp như sau:CH3COOH > CH3CH2OH > CH3-COO-CH3 > CH3-CHO > CH3CH2Cl > C2H6.
Axit axetic có thể làm đổi màu quỳ tím: bới axit axetic là một axit hữu cơ có tính axit yếu nên nó có thể làm quỳ tím chuyển đỏ, dung dịch phenolphtalein chuyển xanh và tác dụng với một số kim loại, oxit bazơ, muối và dung dịch kiềm. Với bản chất là mộ axit nên CH3COOH tác dụng được với một số kim loại như sắt, kẽm, mangan….để tạo thành muối và giải phóng khí hydro. Axit axetic phản ứng với oxit bazơ, dung dịch kiềm để tạo thành muối và nước; có thể phản ứng với dung dịch muối và tạo thành muối mới và axit mới; tác dụng với rượu etylic trong môi trường có axit sulfuric đặc nóng, tạo thành etyl axetat. Đây là một loại este có mùi thơm, tan kém trong nước và chủ yếu được ứng dụng làm dung môi trong công nghiệp.
Một số ứng dụng của axit axetic (CH3COOH):
Trong công nghiệp: Axit axetic được ứng dụng trong nhiều ngành công nghiệp khác nhau như: sử dụng làm polyme trong sản xuất sơn, chất kết dính. Làm dung môi để hòa tan các chất hóa học; Lượng axit axetic dùng làm giấm ăn tuy không chiểm tỷ lệ lớn trong tổng sản lượng axit axetic được sản xuất ra trên thế giới nhưng nó lại là một sản phẩm được sử dụng trong cuộc sống hàng ngày, đặc biệt là nó xuất hiện trong hầu hết các căn bếp của mọi gia đình. Nó là một loại gia vị dùng để tạo độ chua dịu cho món ăn, khử mùi tanh của cá,…
Đối với sức khỏe con người: CH3COOH hỗ trợ điều trị tiểu đường qua việc sử dụng axit axetic sẽ giúp điều tiết lượng đường trong cơ thể về mức ổn định và giảm chứng tăng huyết áp sau khi ăn, đồng thời cải thiện độ nhạy cảm insulin và làm giảm chỉ số đường huyết. Trong giấm ăn có chất pectin- một chất có khả năng đào thải cholesterol trong máu, giảm lượng calo nạp vào cơ thể, từ đó hạn chế sự thèm ăn, ngăn chặn sự tích tụ mỡ trong gan, hạn chế sự hình thành mỡ trong cơ thể,….Nhờ đó, cân nặng được kiểm soát một cách có hiệu quả. Axit axetic là một axit hữu cơ có tính axit yếu và có khả năng phản ứng với kim loại để tạo ra loại muối trung hòa. Điều này sẽ giúp làm tan sỏi trong thận. Tuy nhiên, để đảm bảo an toàn, bạn cần phải sử dụng giấm với liều lượng phù hợp, không nên lạm dụng và trước khi uống phải pha loãng với nước.
Một số lưu ý về CH3COOH: Mặc dù được ứng dụng rộng rãi trong nhiều lĩnh vực của cuộc sống và có khá nhiều lợi ích đối với con người nếu sử dụng đúng cách nhưng axit axetic cũng có thể gây nguy hiểm cho con người, chẳng hạn:Hơi axit axetic sẽ gây kích ứng mũi, cổ họng, phổi và làm tổn thương hệ hô hấp, đặc biệt là lớp lót của cơ quan mũi, thậm chí có thể khiến nạn nhân bị khó thở. Trường hợp nuốt phải axit axetic có thể khiến vùng miệng và đường tiêu hóa bị tổn thương nghiêm trọng. Nạn nhân xuất hiện triệu chứng nôn ói, đau bụng, tiêu chảy, trụy tuần hoàn, suy thận, thậm chí là tử vong. Tiếp xúc với da sẽ gây ra kích ứng như sưng đỏ, mụn nước và nặng hơn là bị phỏng.
1.4. Tính chất của H2O:
Tên gọi phổ biến của hợp chất này là nước. Đây một hợp chất vô cơ, trong suốt, không màu, không mùi và không vị. Nước là thành phần chính và quan trọng nhất cấu tạo nên sự sống trên Trái Đất. Nước sôi ở 100 độ C, hoá rắn ở 0 độ C, gọi là nước đá, khác với nước đá khô là hóa rắn. Nước là một dung môi phân cực có thể hòa tan rất nhiều chất tan phân cực khác ở cả rắn lỏng khí như: axit, đường, muối ăn, khí hidroclorua, khí amoniac…
Nước rất cần thiết cho đời sống hàng ngày, sản xuất nông nghiệp, công nghiệp, xây dựng, giao thông vận tải… Sự sống trên Trái Đất đều bắt nguồn từ nước và phụ thuộc vào nước. Nước có ảnh hưởng quyết định đến khí hậu một khu vực và là nguyên nhân tạo ra thời tiết. Nước là thành phần quan trọng của các tế bào sinh học và là môi trường của các quá trình sinh hóa cơ bản như quang hợp tạo thành khí oxi. Nước còn đóng vai trò quan trọng trong cơ thể người và động vật bới chúng chiếm hơn 70% cơ thể chúng ta.
2. Điều kiện xảy ra phản ứng C2H5OH + O2 → CH3COOH + H2O:
Điều kiện để phản ứng C2H5OH + O2 → CH3COOH + H2O
Phản ứng được thực hiện bằng cách dùng phương pháp lên men dung dịch rượu etylic loãng để sản xuất giấm ăn.
Các phương pháp điều chế axit axetic khác:
Trong công nghiệp, điều chế axit axetc bằng cách sử dụng C4H10 xúc tác với O2 có nhiệt độ tạo thành phản ứng dưới đây:
2C4H10 + 3O2 (xúc tác, nhiệt độ) → 4CH3COOH + 2H2O
Chú ý: Những hợp chất hữu cơ phân tử có chứa nhóm -COOH, có công thức thức CnH2n+1COOH được gọi là axit cacboxylic no đơn chức và cũng có tính chất tương tự axit axetic.
Những hỗn hợp của ancol etylic từ 50 độ trở lên là các chất bắt lửa nên cần bảo quản ở nơi khô thoáng, tránh nơi ánh nắng mặt trời chiếu trực tiếp, tránh xa nơi có bình xịt, các chất ăn mòn, các nguyên tố dễ cháy. Khi tiếp xúc với hóa chất Ancol Etylic cần trang bị đầy đủ các thiết bị bảo hộ như khẩu trang, kính mắt, găng tay,… Tuyệt đối không được lấy cồn công nghiệp để pha ra uống. Khi phát cháy do Ethanol cần dùng bột CO2 hoặc hóa chất khô để dập lửa, tuyệt đối không dùng nước.
3. Bài tập vận dụng liên quan và lời giải hướng dẫn:
Câu 1. Số đồng phân axit ứng với công thức C4H8O2 là?
A. 2.
B. 3.
C. 4.
D. 6
Đáp án: C
Câu 2. Dãy số gồm các chất có nhiệt độ sôi tăng dần từ trái qua phải là:
A. C2H6, C2H5OH, CH3CHO, CH3COOH.
B. C2H6, CH3CHO, C2H5OH, CH3COOH.
C. CH3CHO, C2H6, C2H5OH, CH3COOH.
D. C2H6, CH3CHO, CH3COOH, C2H5OH.
Đáp án: B
Câu 3. So sánh nhiệt độ sôi của các chất: Axit axetic (CH3COOH) , axeton (CH3COCH3), propan (CH3CH2CH3), etanol (C2H5OH):
A. CH3COOH > CH3CH2CH3 > CH3COCH3 > C2H5OH
B. C2H5OH > CH3COOH >CH3CH2CH3 > CH3COCH3
C. CH3COOH > C2H5OH > CH3COCH3 > CH3CH2CH3
D. C2H5OH > CH3COCH3 > CH3COOH > CH3CH2CH3
Đáp án: C
Câu 4. Thực hiện thí nghiệm sau: nhỏ từ từ dung dịch axit axetic vào cốc đựng một mẩu đá vôi. Sau phản ứng có hiện tượng gì xảy ra:
A. Mẩu đá vôi tan dần do axit axetic mạnh hơn axit cacbonic, không thấy có khí thoát ra.
B. mẩu đá vôi tan dần do axit axetic mạnh hơn axit cacbonic, thấy có khí không màu thoát ra.
C. Mẩu đá vôi tan dần, thấy có khí màu lục nhạt thoát ra.
D. mẩu đá vôi không thay đổi do axit axetic yếu hơn axit cacbonic
Đáp án: B