Axit Nitric – HNO3 là gì? Đặc tính Lý hóa của Axit nitric – HNO3 như thế nào? Và quy trình điều chế axit nitric HNO3 cũng như Ứng dụng của axit nitric trong thực tiễn. Bên cạnh đó, liệu axit nitric có độc hại hay không, biện pháp xử lý sự cố do axit nitric gây ra và những lưu ý khi sử dụng axit nitric.
Mục lục bài viết
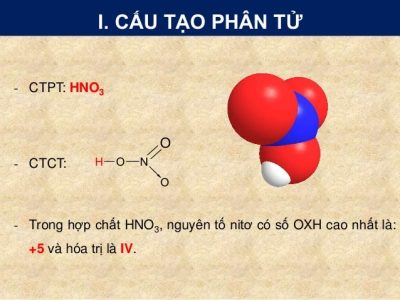
1. Axit nitric có công thức cấu tạo là gì?
Axit nitric là hợp chất vô cơ có công thức hóa học HNO3 – được xem làm một dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Loại axit này được hình thành trong tự nhiên, do trong những cơn mưa do sấm và sét tạo thành. Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm và là một chất axit độc và ăn mòn và dễ gây cháy.
Nếu một dung dịch có hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Axit nitric bốc khói có đặc trưng axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào số lượng nitơ đioxit hiện diện.
Công thức cấu tạo của HNO3:
2. Tính chất vật lý của HNO3:
HNO3 có tính chất vật lý như sau:
– Axit nitric tinh khiết là một chất lỏng không màu và trong suốt, nhưng axit nitric đậm đặc lại có màu vàng nhạt.
– Nó có mùi khó chịu ngột ngạt.
– Khối lượng mol: 63,01214 g/mol (khan) ;81,02742 g/mol ( ngậm 1 nước) và 117,05798 g/mol ( ngậm 3 nước).
– Nhiệt độ sôi: 83°C (181°F; 356 K).
– Nhiệt độ nóng chảy: −42°C (−44°F; 231 K).
– Tan trong nước theo bất kì tỉ lệ nào.
– Axit nitric được sử dụng và thường gặp nhất là ở nồng độ 68%.
– Cần bảo quản HNO3 trong các chai lọ tối màu, tránh nơi có ánh sáng và bảo quản ở nhiệt độ dưới 0 độ C.
– Axit nitric có thể hòa tan nito dioxit thành dung dịch có màu vàng hoặc đỏ ở nhiệt độ cao. Điều này ảnh hưởng không nhỏ đến các đặc trưng vật lý của chất này, đặc biệt là áp suất hơi trên chất lỏng, màu sắc dung dịch, nhiệt độ sôi,… phụ thuộc vào nồng độ NO2.
– Khi chưng cất hỗn hợp HNO3 và H2O ta thu thu được azeotrope có nồng độ 68% HNO3 và sôi ở 120,5 độ C, 1atm.
3. Tính chất hóa học của HNO3:
3.1. Axit nitric là một trong những axit mạnh nhất:
Axit nitric được xếp hạng trong danh sách những axit mạnh nhất. Đây là một axit khan – một monoaxit mạnh có thể nitrat hóa nhiều hợp chất vô cơ với hằng số cân bằng axit (pKa) = -2.
Axit nitric phân li hoàn toàn thành các ion H+ và NO3- trong dung dịch loãng. Dung dịch HNO3 làm quỳ tím chuyển đỏ.
HNO3 có tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo ra muối nitrat.
Ví dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric tác dụng với oxit bazơ, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3.2. Axit nitric có tính oxi hóa:
Axit nitric cũng là 1 trong những axit có tính oxi hóa mạnh. Nó có thể bị khử đến các sản phẩm khác nhau của nitơ, phụ thuộc vào nồng độ axit mạnh hay yếu của chất khử. Cùng tìm hiểu tính oxi hóa của axit nitric thông qua 3 phản ứng:
Một là,Tác dụng với kim loại
Hai là, Tác dụng với phi kim
Ba là, Tác dụng với hợp chất
Tác dụng với kim loại
Axit nitric có khả năng oxi hóa hầu hết các kim loại tạo ra muối nitrat, ngay cả kim loại có tính khử yếu (Cu, Ag)…, ngoại trừ Pt và Au. Lúc này, kim loại bị oxi hóa đến mức cao nhất. Sản phẩm của phản ứng này sẽ là NO2(+4) đối với HNO3 đặc và NO(+2) đối với HNO3 loãng. Nhôm, sắt và crom thụ động với axit nitric đặc nguội vì lớp màng oxit bền được tạo ra bảo vệ chúng không bị oxy hóa tiếp. Đây cũng là lý do bình nhôm hoặc sắt được dùng để đựng HNO3 đặc.
Phương trình phản ứng:
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (nhiệt độ)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2(↑) + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
Tác dụng với phi kim
Khi được đun nóng, HNO3 đặc có khả năng oxi hóa được các phi kim như S, C, P… (các nguyên tố á kim, ngoại trừ halogen và silic). Sản phẩm tạo thành là nito dioxit (nếu là axit nitric đặc) và oxit nito (với axit loãng và nước).
Ví dụ:
S + 6HNO3 đặc → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng với hợp chất
Là một trong những axit cực mạnh, axit nitric (HNO3) đặc có khả năng oxi hóa – phá hủy nhiều hợp chất vô cơ, hữu cơ khác nhau.. Vải, giấy, mùn cưa,… đều bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. Vì vậy, sẽ vô cùng nguy hiểm nếu để axit nitric (HNO3) tiếp xúc với cơ thể người.
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (↓) + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4(↓) + 8NO2 + 4H2O
HNO3 hòa tan Ag3PO4, không tác dụng với HgS.
4. Điều chế và ứng dụng HNO3:
4.1. Điều chế HNO3:
Trong môi trường phòng thí nghiệm
Ở môi trường phòng thí nghiệm, người ta thường cho muối Natri dạng tinh thể kết hợp tác dụng với H2(SO4) đặc. Sau đó sẽ chưng cất hỗn hợp này tại nhiệt độ sôi của chính Axit HNO3 là 83 độ C. Cuối cùng sau khi chưng cất, HNO3 sẽ còn lại đó là một hợp chất kết tủa màu trắng có phương trình hóa học đó là:
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit Nitric sau khi bốc khói đỏ sẽ nhanh chóng chuyển sang dạng hợp chất hóa học Axit Nitric màu trắng. Lưu ý khi thực hiện các thí nghiệm, bạn nên làm bằng các dụng cụ thủy tinh, đặc biệt nên sử dụng các loại bình cổ cong nguyên khối do Axit Nitric khan.
Trong môi trường sản xuất chất hóa học công nghiệp
Axit Nitric (loãng) có thể được điều chế bằng cách cô đặc đến 68% axit hỗn hợp Azeotropic với khoảng 32% là nước. Để thu được axit có nồng độ cao hơn, chúng ta sẽ tiến hành chưng cất HNO3 với hợp chất dung dịch axit H2SO4 (axit sunfuric).
H2So4 sẽ đóng vai trò như 1 chất khử mạnh, nó sẽ hấp thụ lại H2O. Với phương trình hóa học cụ thể như sau:
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit Nitric điều chế ở điều kiện công nghiệp sẽ có nồng độ là 52% và 68%. Việc sản xuất Axit Nitric được thực hiện và điều chế hoàn toàn bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
4.2. Ứng dụng HNO3:
Trong phòng thí nghiệm
Axit nitric là thuốc thử chính được sử dụng cho quá trình nitrat hóa – việc bổ sung một nhóm nitro, điển hình là một phân tử hữu cơ. Và nó cũng thường được sử dụng như một tác nhân oxy hóa mạnh.
Axit nitric cũng được sử dụng trong phòng thí nghiệm trường học để tiến hành các thí nghiệm liên quan đến việc thử clorit. Cho axit nitric (HNo3) tác dụng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua.
Trong hóa chất công nghiệp
Axit Nitric nồng độ 68% được mang sử dụng để có thể chế tạo ra các loại thuốc nổ cơ bản như TNT hay như cyclotrimethylenetrinitramin (RDX).
Axit nitric có nồng độ 0,5-2% được sử dụng làm hợp chất nền nhằm xác định trong dung dịch có tồn tại kim loại không. Người ta gọi đó là kỹ thuật ICP-MS và ICP-AES.
Người ta còn sử dụng Axit Nitric để sản xuất ra các hợp chất hữu cơ, bột màu, các loại thuốc nhuộm vải và chất tẩy màu.
Axit nitric được dùng để sản xuất nitrobenzen – tiền chất để sản xuất anilin và các dẫn xuất anilin với những ứng dụng then chốt trong sản xuất bọt xốp polyuretan, sợi aramid và dược phẩm.
Ở điều kiện nồng độ hóa học thấp (khoảng 10%) axit nitric thường sẽ được dùng để nhân tạo thông và maple. Màu sắc khi được tạo ra nhờ phản ứng sẽ có một màu khá giống màu vàng xám kiểu như màu gỗ cũ hoặc gỗ đã thành phẩm.
HNO3 còn được dùng làm các loại chất tẩy rửa đường ống, tẩy rửa bề mặt kim loại có trong các nhà máy sản xuất sữa.
Axit Nitric được dùng để loại bỏ các tạp chất, có khả năng cân bằng lại mức độ tiêu chuẩn của H2O.
Sử dụng để điều chế các loại phân bón hóa học, phân đạm, các loại muối nitrate ngành phân bón như: KNO3, Ca(NO3)2,..
5. Những lưu ý khi sử dụng HNO3:
5.1. Những tổn thương khi tiếp xúc:
– Tiếp xúc theo đường mắt: Gây kích ứng có thể gây bỏng làm mù lòa.
– Tiếp xúc theo đường thở: Gây kích ứng nghiêm trọng. Hít phải có thể gây khó thở và dẫn đến viêm phổi và tử vong. Triệu chứng khác bao gồm: Ho, nghẹt thở, kích ứng mũi và đường hô hấp.
– Tiếp xúc theo đường da: Gây kích ứng, mẩn đỏ, đau và bỏng nặng.
– Tiếp xúc theo đường tiêu hóa: nếu nuốt phải có thể gây cháy miệng, dạ dày.
– Phơi nhiễm lâu có thể dẫn tới ung thư.
5.2. Biện pháp xử lý sự cố do HNO3 gây ra:
– Hít phải: tìm kiếm không khí trong lành và chăm sóc y tế ngay lập tức.
– Tiếp xúc mắt: ngay lập tức rửa mắt bằng nhiều nước trong ít nhất 15 phút để ngăn ngừa tổn thương thêm, sau đó lập tức tìm kiếm sự chăm sóc y tế.
– Tiếp xúc với da: ngay lập tức rửa sạch vùng bị ảnh hưởng với nhiều nước trong ít nhất 15 phút. Loại bỏ quần áo bị ô nhiễm và rửa bằng xà bông. Chăm sóc y tế ngay lập tức khi được yêu cầu.
– Nuốt phải: súc miệng bằng nước hoặc sữa. Lưu ý rằng không được phép cho bất cứ thứ gì vào miệng của nạn nhân khi họ đã bất tỉnh để tránh những trường hợp kích ứng. Tìm kiếm sự chăm sóc y tế nhanh nhất có thể.
5.3. Những lưu ý khi sử dụng:
– Axit nitric có tính oxy hóa và ăn mòn ở cả dung dịch đậm đặc và loãng nên rất nguy hiểm cho con người, bắn vào da, mắt có thể gây bỏng nặng. Sau khi da tiếp xúc với axit nitric sẽ từ từ chuyển sang màu vàng, cuối cùng lớp biểu bì bị ố vàng sẽ bong ra (do axit nitric và protein tiếp xúc sẽ gây ra phản ứng xanthin và biến tính).
– Hít phải khí của axit nitric lỏng có thể gây kích ứng đường hô hấp và có thể gây phù phổi cấp tính. Nếu uống nhầm hóa chất này gây đau bụng dữ dội. Trong trường hợp nghiêm trọng, có thể gây thủng dạ dày, co thắt thanh quản, tổn thương thận, sốc và ngạt thở.
– Axit nitric đậm đặc cần được đựng trong chai thủy tinh sẫm màu để tránh phản ứng với ánh sáng giải phóng NO2 độc hại.
– Bảo quản HNO3 trong kho mát, thông gió. Tránh xa lửa và nguồn nhiệt. Nhiệt độ bảo quản không vượt quá 30 ℃ và độ ẩm tương đối không vượt quá 80%, bình chứa phải đậy nắp kín. Nó nên được bảo quản riêng biệt với các chất khử, kiềm, và kim loại kiềm.
6. Bài tập về HNO3:
6.1. Dạng 1 Kim loại tác dụng với HNO3:
Bài 1. Hoà tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ duy nhất (đktc). Xác định kim loại X?
Bài 2. Hòa tan 16,2 gam kim loại hoá trị III vào 5 lít dung dịch HNO3 0,5 M (D = 1,25 g/ml). Sau khi phản ứng kết thúc thu được 2,8 lit hỗn hợp khí X gồm NO, N2 (0oC, 2 atm). Trộn hỗn hợp khí X với lượng oxi vừa đủ sau phản ứng thấy thể tích khí chỉ bằng 5/6 tổng thể tích X và oxi mới cho vào.
- Tìm kim loại đã dùng.
- Tính nồng độ % dung dịch HNO3 sau phản ứng.
Bài 3. Hoà tan hoàn toàn 17.28 gam Mg vào dung dịch HNO3 0,1M thu được dung dịch A và 1,344 lít hỗn hợp khí X gồm N2 và N2O (ở 00C, 2 atm). Thêm một lượng dư KOH vào dung dịch A, đun nóng thì có một khí thoát ra. Khí này tác dụng vừa đủ với 200 ml dung dịch H2SO4 0,1 M. Tính thể tích mỗi khí trong hỗn hợp X.
6.2. Dạng 2 Kim loại phản ứng với hỗn hợp HNO3 và H2SO4:
Bài 1: Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8 M và H2SO4 0,2 M. Sau khi phản ứng hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất đktc). Tìm giá trị của V?
Bài 2: Hoà tan hoàn toàn m gam hỗn hợp X (Cu, Ag) trong dung dịch chứa HNO3 và H2SO4 thu được dung dịch Y chứa 7,06 gam muối và hỗn hợp khí Z chứa 0,05 mol NO2 và 0,01 mol SO2. Giá trị của m là?
Bài 3: Cho 12,9 gam hỗn hợp Al và Mg phản ứng với 100 ml dung dịch hỗn hợp HNO3 và H2SO4 thu được 0,1 mol mối khí SO2, NO, N2O. Cô cạn dung dịch thu được sau phản ứng được bao nhiêu gam muối khan?
6.3. Dạng 3 Chứng minh tính oxi hoá của NO3- – Kim loại phản ứng với muối nitrat trong môi trường axit:
Bài 1. Cho một lượng Cu2S tác dụng hoàn toàn với dung dịch HNO3 đun nóng. Phản ứng tạo thành dung dịch A1 và làm giải phóng ra khí A2 không màu, bị hoá nâu trong không khí. Chia A1 thành hai phần. Thêm dung dịch BaCl2 vào phần 1, thấy tạo thành kết tủa trắng A3 không tan trong axit dư. Thêm lượng dư dung dịch NH3 vào phần hai đồng thời khuấy đều hỗn hợp, thu được dung dịch A4 có màu xanh đậm.
- Hãy xác định A1, A2, A3, A4là gì?
- Viết phương trình phản ứng mô tả các quá trình hoá học vừa nêu trên.
Bài 2. Cho 19,2 g Cu vào 500 ml dung dịch NaNO3 1M, sau đó thêm 500 ml dung dịch HCl 2M được dung dịch A
- Cu có tan hết không? Tính thể tích NO bay ra ở đktc.
- Tính nồng độ mol các ion trong dung dịch A thu được sau phản ứng.
- Phải thêm bao nhiêu lítdung dịch NaOH 0,2 M để kết tủa hết Cu2+chứa trong dung dịch A.
Bài 3. Hoà tan 26,88 gam bột kim loại đồng trong dung dịch HNO3 loãng. Sau khi kết thúc phản ứng, có 4,48 lít khí NO (đktc) thoát ra và còn lại m gam chất không tan. Thêm tiếp từ từ V ml dung dịch HCl 3,2 M vào để hoà tan vừa hết m gam chất không tan, có khí NO thoát ra (duy nhất). Xác định trị số của V?
6.4. Dạng 4 Bài toán tổng hợp axit nitric tác dụng với kim loại:
Bài 1. So sánh thể tích khí NO (duy nhất) thoát ra trong 2 thí nghiệm sau (các khí đo trong cùng điều kiện):
TN1: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1,0 mol/lít.
TN2: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1,0 mol/lít và H2SO4 0,5 mol/lít.
Bài 2. Nung x mol Fe trong không khí một thời gian thu được 16,08 gam hỗn hợp H gồm 4 chất rắn gồm Fe và 3 oxit của nó. Hòa tan hết lượng hỗn hợp H trên bằng dung dịch HNO3 loãng, thu được 672 ml khí NO duy nhất (đktc). Xác định trị số của x?
Bài 3. Cho 13,6 gam hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn X thu được bao nhiêu gam muối khan?