Rượu đã không còn xa lạ gì với chúng ta nhưng nó được cấu tạo như nào, có tính chất ra sao thì không phải ai cũng biết. Vậy bài viết dưới đây cung cấp thông tin hóa học liên quan đến rượu tới các bạn đọc.
Mục lục bài viết
1. Ancol là gì?
Ancol là còn được gọi là rượu, là một hợp chất hữu cơ mà trong phân tử chứa một hay nhiều nhóm hiđroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no của gốc hiđrocacbon.
Công thức chung: R – OH.
Trong đó: R là hidrocacbon: có thể no hay không no
Ví dụ: CH3OH, C2H5OH, CH3CH2CH2OH, CH2=CHCH2OH, C6H5CH2OH …
2. Tính chất của Ancol:
2.1. Tính chất vật lý:
R-OH tạo liên kết hidro nên dẫn đến nhiệt độ sôi của ancol cao hơn các dẫn xuất của hydrocarbon có khối lượng phân tử tương đương. Dưới đây là thứ tự nhiệt độ sôi giảm dần của một số nhóm hợp chất hữu cơ:
R-COOH > R-OH > RNR’ > R-COO-R’ > R-CO-R’> R-CHO > RX > R-O-R’ > RH
tương đương
Axit > ancol > amin > este > xeton > anđehit > dẫn xuất halogen > ete > hidrocacbon CxHy
Giải thích: nhiệt độ sôi của một chất thường phụ thuộc vào các yếu tố sau:
– Khối lượng phân tử càng lớn thì nhiệt độ sôi càng cao.
– Độ phân cực của liên kết: liên kết ion > liên kết cộng hóa trị có cực > liên kết cộng hóa trị không cực.
– Số liên kết hiđro: càng nhiều liên kết hidro thì nhiệt độ sôi càng cao.
– Độ bền của liên kết hiđro: liên kết H càng bền thì nhiệt độ sôi càng cao.
Độ tan của ancol tùy thuộc vào số nguyên tử C trong phân tử:
C1-C3: tan tốt trong nước
C4-C7: tan 1 phần trong nước
C8 trở lên: không tan trong nước
Từ C1 đến C12 ancol là chất lỏng, từ C13 trở lên ancol là chất rắn.
2.2. Tính chất hóa học:
2.2.1. Ancol phản ứng với kim loại kiềm (Ancol + Na):
Phản ứng của Ancol + Na
R(OH)z + zNa → R(ONa)z + z/2H2↑
Ancol hầu như không phản ứng được với NaOH mà ngược lại natri ancolat bị phân hủy hoàn toàn
R(ONa)z + zH2O → R(OH)z + zNaOH
Chú ý: – Trong phản ứng của ancol với Na:
mbình Na tăng = mAncol – mH2 = nAncol.(MR + 16z).
mbình Ancol tăng = mNa – mH2 = nAncol.22z.
– Nếu cho dung dịch ancol phản ứng với Na thì ngoài phản ứng của ancol còn có phản ứng của H2O với Na.
– Số nhóm chức Ancol = 2.nH2/nAncol.
2.2.2. Ancol phản ứng với axit:
a) Ancol phản ứng với axit vô cơ HX (Ancol + H2SO4, Ancol + HCl)
CnH2n+2-2k-z(OH)z + (z + k)HX → CnH2n + 2 – zXz + k
b) Ancol phản ứng với axit hữu cơ (phản ứng este hóa)
ROH + R’COOH ↔ R’COOR + H2O
yR(OH)x + xR’(COOH)y ↔ R’x(COO)xyRy + xyH2O
Chú ý:
– Phản ứng được thực hiện trong môi trường axit và đun nóng.
– Phản ứng có tính thuận nghịch nên chú ý đến chuyển dịch cân bằng.
2.2.3. Phản ứng tách nước (đề hiđrat hóa):
a) Tách nước từ 1 phân tử ancol tạo anken của ancol no, đơn chức, mạch hở.
CnH2n+1OH → CnH2n + H2O (H2SO4 đặc, >1700C)
– Điều kiện của ancol tham gia phản ứng: ancol có Hα.
Chú ý:
– Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó không có Hα (là CH3OH hoặc ancol mà nguyên tử C liên kết với OH chỉ liên kết với C bậc 3 khác).
– Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken thì đó là ancol bậc cao (bậc II, bậc III) và mạch C không đối xứng qua C liên kết với OH.
– Nhiều ancol tách nước tạo ra một anken thì xảy ra các khả năng sau:
+ Có ancol không tách nước.
+ Các ancol là đồng phân của nhau.
– Sản phẩm chính trong quá trình tách nước theo quy tắc Zaixep.
– Khi giải bài tập có liên quan đến phản ứng tách nước cần nhớ:
mAncol = manken + mH2O + mAncol dư
nancol phản ứng = nanken = nnước
– Các phản ứng tách nước đặc biệt:
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
b) Tách nước từ 2 phân tử ancol tạo ete
ROH + ROH → ROR + H2O (H2SO4 đặc; 1400C)
ROH + R’OH → ROR’ + H2O (H2SO4 đặc; 1400C)
Chú ý:
– Từ n ancol khác nhau khi tách nước ta thu được n.(n + 1)/2 ete trong đó có n ete đối xứng.
– Nếu tách nước thu được các ete có số mol bằng nhau thì các ancol tham gia phản ứng cũng có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và nAncol = mete + nH2O + mAncol dư.
2.2.4. Phản ứng oxi hóa (Ancol + O2):
a) Oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
Chú ý:
– Phản ứng đốt cháy của ancol có đặc điểm tương tự phản ứng đốt cháy hiđrocacbon tương ứng.
+ Nếu đốt cháy ancol cho nH2O > nCO2 → ancol đem đốt cháy là ancol no và nAncol = nH2O – nCO2.
+ Nếu đốt cháy ancol cho nH2O > 1,5.nCO2 → ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin).
– Khi đốt cháy 1 hợp chất hữu cơ X thấy nH2O > nCO2 → chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở (cùng có công thức CnH2n+2Ox).
b) Oxi hóa không hoàn toàn (Ancol + CuO hoặc O2 có xúc tác là Cu)
– Ancol bậc I + CuO tạo anđehit:
RCH2OH + CuO → RCHO + Cu + H2O
– Ancol bậc II + CuO tạo xeton:
RCHOHR’ + CuO → RCOR’ + Cu + H2O
– Ancol bậc III không bị oxi hóa bằng CuO.
Chú ý: mchất rắn giảm = mCuO phản ứng – mCu tạo thành = 16.nAncol đơn chức.
2.2.5. Phản ứng riêng của một số loại ancol:
a) Ancol etylic CH3CH2OH:
C2H5OH + O2 → CH3COOH + H2O (men giấm)
2C2H5OH → CH2=CH-CH=CH2 + 2H2O + H2 (Al2O3, ZnO, 4500C)
b) Ancol không no có phản ứng như hidrocacbon tương ứng
– Phản ứng với Hidro, alylic CH2 = CH – CH2OH: Ancol + H2
CH2=CH-CH2OH + H2 → CH3-CH2-CH2OH (Ni, t0)
– Phản ứng với Brom: Ancol + Br2
CH2=CH-CH2OH + Br2 → CH2Br-CHBr-CH2OH
– Phản ứng với dd thuốc tím: Ancol + KMnO4
3CH2=CH-CH2OH + 2KMnO4 + 4H2O → 3C3H5(OH)3 + 2KOH + 2MnO2
c) Ancol đa chức có các nhóm OH liền kề: tạo dung dịch màu xanh lam với Cu(OH)2 ở nhiệt độ thường:
2R(OH)2 + Cu(OH)2 → [R(OH)O]2Cu + 2H2O
d) Một số trường hợp ancol không bền:
– Ancol có nhóm OH liên kết với C nối đôi chuyển vị thành anđehit hoặc xeton:
CH2=CH-OH → CH3CHO
CH2=COH-CH3 → CH3-CO-CH3
– Ancol có 2 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo anđehit hoặc xeton:
RCH(OH)2 → RCHO + H2O
HO-CO-OH → H2O + CO2
RC(OH)2R’ → RCOR’ + H2O
– Ancol có 3 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo thành axit:
RC(OH)3 → RCOOH + H2O
3. Phân loại Ancol:
Dựa vào đặc điểm của gốc hiđrocacbon, ancol được chia thành :
– Ancol no.
– Ancol không no.- Ancol thơm ( phân tử có vòng benzen ).
Dựa vào số nhóm –OH trong phân tử, các ancol được chia thành:
– Ancol đơn chức.
– Ancol đa chức.
– Ancol còn được phân loại theo bậc ancol
a) Ancol no, đơn chức, mạch hở:
Phân tử có một nhóm –OH liên kết với gốc ankyl.
CTTQ : CnH2n+1-OH hay CnH2n+2O ( n ≥ 1)
Ví dụ: CH3-OH, C2H5-OH, …
b) Ancol không no, đơn chức, mạch hở :
Phân tử có một nhóm –OH liên kết với nguyên tử cacbon no của gốc hiđrocacbon không no.
Ví dụ: CH2=CH-CH2-OH
CH≡C-CH2-OH
*Ancol không no, một nối đôi, đơn chức, mạch hở:
Ví dụ : CH2=CH-CH2-OH
CH2=CH-CH2-CH2-OH
CH2=CH-CH2-CH2-CH2-OH
CTTQ : CnH2n1OH (n≥3)
c) Ancol thơm, đơn chức:
Phân tử có nhóm –OH liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen.
d) Ancol vòng no, đơn chức:
Phân tử có một nhóm –OH liên kết với nguyên tử cacbon no thuộc gốc hiđrocacbon vòng no.
e) Ancol đa chức:
Phân tử có hai hay nhiều nhóm –OH ancol.
Ví dụ: Etylen glicol, glixerol
* Ancol no, đa chức : CnH2n+2Ox hay CnH2n+2x(OH)x (n≥ 3)
* Phân loại theo bậc của ancol: Bậc của ancol được tính bằng bậc của nguyên tử cacbon no liên
kết với nhóm –OH.
– Bậc của nguyên tử cacbon no được tính bằng số liên kết của nguyên tử cacbon đó với các nguyên tử cacbon khác.
4. Điều chế Ancol và ứng dụng:
4.1. Phương pháp tổng hợp:
a) Điều chế ancol từ anken tương ứng:
– Trong công nghiệp tổng hợp etanol từ etilen.
![]()
– Ngoài ra còn có thể tổng hợp ancol bằng cách thủy phân dẫn xuất halogen trong dung dịch kiềm.
b) Tổng hợp glixerol từ propylen:
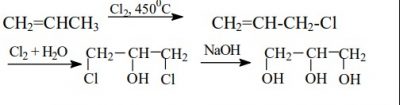
4.2. Ứng dụng:
– Metanol chủ yếu được dùng để sản xuất Andehit Fomic nguyên liệu cho công nghiệp chất dẻo.
– Etanol dùng để điều chế một số hợp chất hữu cơ như axit axetic, dietyl ete, etyl axetat…Do có khả năng hòa tan tốt một số hợp chất hữu cơ nên Etanol được dùng để pha vecni, dược phẩm, nước hoa… Trong đời sống hàng ngày Etanol được dùng để pha chế các loại đồ uống với độ ancol khác nhau.
5. Cách nhận biết Ancol:
Có thể kể đến một số phương pháp nhận biết rượu:
– Rượu phản ứng với kim loại kiềm tạo thành chất khí không màu.
– Rượu sẽ chuyển từ màu đen sang màu đỏ khi đun nóng.
– Nếu hợp chất là rượu đa chức chứa nhóm oh liền kề thì cu (oh) 2 sẽ tan tạo dung dịch màu xanh lam.
– Nếu hợp chất là ancol không no thì phản ứng làm mất màu dung dịch brom.
6. Bài tập minh họa:
Dạng 1: Ancol tách nước
Bài 1: Đun 132,8 gam hỗn hợp 3 rượu no, đơn chức với H2SO4 đặc ở 140oC thu được hỗn hợp các ete có số mol bằng nhau và có khối lượng là 111,2 gam. Số mol của mỗi ete trong hỗn hợp là bao nhiêu ?
A. 0,1 mol.
B. 0,15 mol.
C. 0,4 mol.
D. 0,2 mol.
Hướng dẫn giải
Ta biết rằng cứ 3 loại rượu tách nước ở điều kiện H2SO4 đặc, 140oC thì tạo thành 6 loại ete và tách ra 6 phân tử H2O.
Theo ĐLBTKL ta có
mH2O = mrượu – mete = 132,8 – 111,2 = 21,6g
⇒ nH2O = 1,2 mol = nete
nmỗi ete = 1,2/6 = 0,2 mol ⇒ Đáp án D
Dạng 2: Ancol tác dụng với Na
Cho 13,8 gam ancol A tác dụng với Na dư giải phóng 5,04 lít H2 ở đktc, biết MA < 100. Vậy A có công thức cấu tạo thu gọn là :
A. CH3OH.
B. C2H5OH.
C. C3H6(OH)2.
D. C3H5(OH)3.
Hướng dẫn giải
Đặt công thức của ancol là R(OH)n.
Phương trình phản ứng :
2R(OH)n + 2Na → 2R(ONa)n + nH2 (1)
13,8/(R+17n) →
13,8/(R+17n). n/2 (mol)
Theo (1) và giả thiết ta có : nH2 = 13,8/(R+17n). n/2 = 0,225 mol
⇒ R = 41/3n ⇒ n = 3; R = 41
Vậy A có công thức cấu tạo thu gọn là C3H5(OH)3
⇒ Đáp án D
Dạng 3: Ancol bị oxi hóa không hoàn toàn
Cho m gam một ancol (rượu) no, đơn chức X qua bình đựng CuO (dư), nung nóng. Sau khi phản ứng hoàn toàn, khối lượng chất rắn trong bình giảm 0,32 gam. Hỗn hợp hơi thu được có tỉ khối đối với hiđro là 15,5. Giá trị của m là?
Hướng dẫn giải
Đặt công thức phân tử của ancol no, đơn chức X là : CnH2n + 2O
Phương trình phản ứng :
CnH2n + 2O + CuO → CnH2nO + H2O + Cu (1)
x x → x → x → x (mol)
mc/r giảm = mCuO – mCu = 80x – 64x = 0,32 => x = 0,02
Hỗn hợp hơi gồm CnH2nO và H2O có M=15,5.2 = 31 và n = 0,02.2 = 0,04 mol.
Áp dụng định luật bảo toàn khối lượng ta có :
mancol = mhỗn hợp hơi + mCu – mCuO
mancol = 0,04.31 + 0,02,64 – 0,02.80 = 0,92 gam




