Mục lục bài viết
1. Cấu tạo của Phenol:
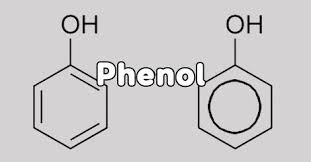
Phenol là một nhóm các hợp chất hữu cơ có nhóm hydroxyl (-OH) được liên kết trực tiếp với một nguyên tử cacbon trong vòng benzen. Nhóm -OH này được gọi là nhóm -OH phenol.
Công thức phân tử: C6H6O
Công thức cấu tạo: C6H5OH
Phenol đơn giản nhất có công thức cấu tạo là C6H5OH. Mặc dù phenol đơn giản nhất thường được xem xét, cũng cần lưu ý rằng còn có các dẫn xuất khác như crezol (CH3–C6H4–OH) và các hydroxybenzen (o-catechol, m-rezoxinol, p-hydroquinol).
Điểm khác biệt giữa Phenol và Ancol Thơm:
Phải phân biệt rõ giữa phenol và ancol thơm, mặc dù cả hai đều có vòng benzen. Sự khác biệt chính là trong cấu trúc hóa học của chúng, đặc biệt là về vị trí của nhóm hydroxyl (-OH). Trong phenol, nhóm -OH được liên kết trực tiếp với vòng benzen trong khi đó, tại ancol thơm nhóm -OH nằm trong nhánh của vòng benzen.
Phân biệt giữa chúng có thể giúp hiểu rõ hơn về tính chất và ứng dụng của từng loại hợp chất trong nhiều lĩnh vực khác nhau, từ hóa học hữu cơ đến ứng dụng công nghiệp và y học.
Phenol được phân loại dựa trên số lượng nhóm hydroxyl (-OH) trong phân tử thành hai loại chính:
– Phenol đơn chức (Monophenol):
Đây là loại phenol trong đó mỗi phân tử chỉ chứa một nhóm hydroxyl (-OH).
Ví dụ về các phenol đơn chức bao gồm P-crezol, m-crezol, o-crezol và các dẫn xuất khác.

– Phenol đa chức (Polyphenol):
Loại này bao gồm các phenol có hai hoặc nhiều nhóm hydroxyl (-OH) trong cùng một phân tử.
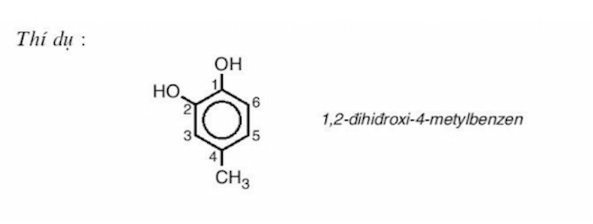
Phân loại này dựa trên sự khác biệt về số lượng nhóm -OH trong phân tử của phenol, ảnh hưởng đến tính chất và ứng dụng của chúng trong nhiều lĩnh vực khác nhau.
2. Tính chất của Phenol:
Tính chất vật lý của Phenol
Phenol là một hợp chất hữu cơ thơm thường tồn tại dưới dạng tinh thể rắn. Ở nhiệt độ phòng, nó có dạng tinh thể không màu và có mùi đặc trưng. Đây là một chất độc hại và khi để lâu ngoài không khí, phenol có thể bị oxi hóa, chuyển thành màu hồng và bắt đầu chảy rữa do hấp thụ hơi nước từ môi trường xung quanh.
Nhiệt độ nóng chảy của phenol là khoảng 43°C nên nó có thể tồn tại ở dạng rắn ở điều kiện phòng. Tuy nhiên, khi nhiệt độ tăng, phenol sẽ tan chảy tạo thành một chất lỏng trong suốt.
Phenol ít tan trong nước lạnh nhưng lại hoàn toàn tan trong nước nóng (khoảng 66°C). Điều này là do nước nóng có khả năng tạo ra các liên kết hydro với các phân tử phenol giúp chúng tan trong dung dịch. Ngoài ra, phenol cũng có khả năng tan trong một số dung môi hữu cơ khác như ethanol, ether và các hydrocacbon.
Tính chất hóa học của Phenol
Phenol có tính chất hóa học đa dạng và phong phú điều này làm cho nó trở thành một chất thú vị trong nhiều ứng dụng khác nhau.
– Phản ứng thế nguyên tử hydrogen của nhóm -OH
Phenol có nhóm hydroxyl (-OH) gắn trực tiếp vào vòng Benzen tạo ra một số phản ứng đặc trưng của nhóm này.
+ Tác dụng với kim loại kiềm: Khi phenol tác dụng với kim loại kiềm như natri, khí hidro sẽ được giải phóng. Phản ứng có thể được mô tả bởi phản ứng sau:2C6H5OH + 2Na → 2C6H5ONa + H2Phản ứng này có thể được sử dụng để phân biệt phenol và anilin.
+ Tác dụng với dung dịch bazơ: Khi phenol tác dụng với dung dịch bazơ mạnh như NaOH, nó tan trong dung dịch và tạo ra phenolat.C6H5OH + NaOH → C6H5ONa + H2O
Phenol có tính axit yếu, nhưng không đủ mạnh để làm đổi màu quỳ tím.
– Phản ứng thế nguyên tử hydrogen của vòng Benzen
Phenol cũng có thể tham gia vào các phản ứng thế nguyên tử hydrogen của vòng Benzen trong cấu trúc của nó.
+ Khi tác dụng với nước brom, phenol tạo ra kết tủa trắng:C6H5OH + Br2 → C6H5Br + HBr + H2O
+ Khi tác dụng với axit nitric, phenol tạo ra axit picric:C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Nhóm -OH gắn vào vòng Benzen trong phân tử phenol tăng cường tính phản ứng của nguyên tử hydrogen so với các hidrocacbon thơm khác. Điều này là do hiệu ứng đẩy của nhóm -OH tác động lên vòng Benzen, làm tăng sự dễ dàng cho các phản ứng thế.
Chú ý rằng ngoài phenol, tất cả các chất thuộc nhóm phenol khác mà có nguyên tử hydrogen ở vị trí ortho hoặc para so với nhóm -OH đều có thể tham gia vào các phản ứng thế brom và thế nitro tương tự.
3. Cách điều chế của Phenol:
Trong công nghiệp, phenol thường được điều chế bằng cách oxi hóa cumen – một loại hydrocacbon thông qua phản ứng với không khí. Sau đó, sản phẩm được thu được từ phản ứng này được thủy phân trong dung dịch axit sulfuric loãng. Quá trình này tạo ra hai sản phẩm chính là phenol và axeton.
Cách điều chế phenol bắt đầu bằng việc oxi hóa cumen, một hydrocacbon có công thức hóa học là C9H12 thông qua phản ứng với không khí. Trong quá trình này, cumen tác động với không khí trong môi trường xúc tác để tạo ra hydroperoxit cumen. Sau đó, hydroperoxit cumen này được phân hủy thành phenol và axeton.
Sau khi phản ứng oxi hóa cumen, hỗn hợp sản phẩm thu được chứa cả phenol và axeton. Để tách chúng ra, hỗn hợp này được đun nóng để bay hơi axeton. Quá trình bay hơi này diễn ra ở nhiệt độ và áp suất phù hợp và sau đó, hơi axeton được ngưng tụ lại để tách riêng.
Khi axeton đã được tách ra, phần còn lại trong dung dịch là phenol được thu gom và tinh chế để sử dụng trong các ứng dụng khác nhau.
Bên cạnh phương pháp trên, phenol cũng có thể được điều chế từ benzen thông qua một chuỗi các phản ứng hóa học.
Trong quá trình này, benzen trước tiên tác động với brom để tạo ra bromobenzen được xúc tác bởi bột sắt. Tiếp theo, bromobenzen phản ứng với dung dịch NaOH đặc tạo ra phenolat natri và bromua natri. Sau đó, phenolat natri phản ứng với CO2 trong môi trường nước để tạo ra phenol và các sản phẩm phụ như bicarbonate natri.
Ngoài ra, phenol cũng có thể được tách ra từ nhựa than đá. Quá trình này bắt đầu bằng việc cho nhựa than đá phản ứng với dung dịch NaOH dư. Sau đó, từ từ phenolat natri tạo ra từ phản ứng được tách chiết ra khỏi dung dịch. Cuối cùng, phenolat natri này được axit hoá để tách ra phenol.
4. Ứng dụng của Phenol:
Phenol không chỉ có nhiều ứng dụng trong cuộc sống hàng ngày mà còn đóng vai trò quan trọng trong công nghiệp.
– Nguyên liệu sản xuất nhựa phenol formaldehyde (Bakelite):
Phenol được sử dụng chủ yếu trong việc sản xuất nhựa phenol formaldehyde còn được gọi là Bakelite. Loại nhựa này được sử dụng rộng rãi trong việc chế tạo đồ dân dụng như đồ gia dụng, tay nắm cửa, ốp tường và nhiều ứng dụng khác.
Bakelite cũng được sử dụng trong ngành công nghiệp điện tử để sản xuất cách điện và cách nhiệt.
– Sản xuất nhựa poly (Phenolic Resin):
Phenol thường được sử dụng để sản xuất nhựa poly (phenolic resin), một loại nhựa chịu nhiệt và chịu hóa chất tốt. Nhựa poly được sử dụng trong việc chế tạo đồ gia dụng, vật liệu cách điện, vật liệu chống cháy và nhiều ứng dụng công nghiệp khác.
– Sản xuất thuốc nhuộm và thuốc nổ:
Phenol được sử dụng làm chất nguyên liệu để sản xuất thuốc nhuộm và thuốc nổ. Trong quá trình tổng hợp axit picric, phenol là một thành phần chính để tạo ra loại thuốc nổ mạnh mẽ và ổn định.
– Tổng hợp tơ polyamide:
Phenol cũng được sử dụng trong ngành công nghiệp hóa chất để tổng hợp các loại tơ polyamide. Các loại tơ này được sử dụng rộng rãi trong việc sản xuất sợi và vải tổng hợp, góp phần vào ngành dệt may và sản xuất sợi công nghiệp.
– Chất kích thích tăng trưởng ở thực vật:
Một ứng dụng khác của phenol là trong việc điều chế và sản xuất chất kích thích tăng trưởng ở thực vật, như kích thích tố thực vật 2,4 – D. Loại chất này được sử dụng trong nông nghiệp để kiểm soát cỏ dại và tăng cường sinh trưởng của cây trồng.
– Chất sát trùng và chống nấm mốc:
Phenol cũng được sử dụng làm chất sát trùng và điều chế các sản phẩm để diệt khuẩn, nấm mốc và sâu bọ. Các sản phẩm chứa phenol thường được sử dụng để vệ sinh, làm sạch và bảo quản trong ngành y tế và gia đình.
– Khả năng độc hại của phenol:
Phenol là một chất rất độc hại và có thể gây ra tổn thương nghiêm trọng cho sức khỏe con người và môi trường. Khi tiếp xúc trực tiếp với da, phenol có thể gây ra bỏng nặng và tổn thương cho mắt. Đối với môi trường, phenol được xem là một chất gây ô nhiễm và có thể tích tụ trong cơ thể sinh vật, gây hại cho sức khỏe và hệ sinh thái.
THAM KHẢO THÊM: