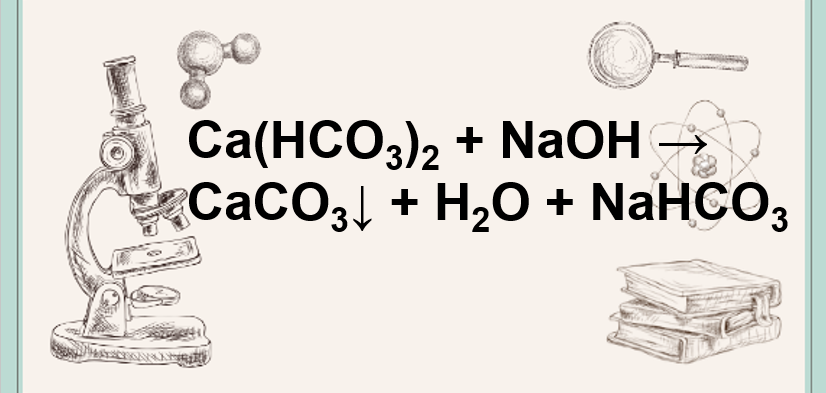Khi hòa tan natri hidrocacbonat (NaHCO3) vào dung dịch natri hidroxit (NaOH), phản ứng xảy ra tạo ra natri cacbonat (Na2CO3) và nước (H2O) theo phương trình hóa học: NaHCO3 + NaOH → Na2CO3 + H2O
Mục lục bài viết
1. Tính chất phương trình NaHCO3 + NaOH → Na2CO3 + H2O:
Khi hòa tan natri hidrocacbonat (NaHCO3) vào dung dịch natri hidroxit (NaOH), phản ứng xảy ra tạo ra natri cacbonat (Na2CO3) và nước (H2O) theo phương trình hóa học:
NaHCO3 + NaOH → Na2CO3 + H2O
Trong phản ứng này, NaOH đóng vai trò là chất axit và NaHCO3 là chất bazơ. Khi phản ứng xảy ra, ion hidroxit (OH-) của NaOH và ion hidrocacbonat (HCO3-) của NaHCO3 tương tác với nhau và tạo thành ion cacbonat (CO32-) và nước (H2O). Sau đó, ion natri (Na+) tương tác với ion cacbonat (CO32-) để tạo thành natri cacbonat (Na2CO3).
Phản ứng này là phản ứng trung hòa, có nghĩa là dung dịch sau phản ứng có độ pH chỉ bằng 7. Nó cũng là phản ứng xảy ra khi muối natri cacbonat được sản xuất công nghiệp.
2. Điều kiện xảy ra phản ứng NaHCO3 + NaOH → Na2CO3 + H2O:
Để phản ứng trên xảy ra, cần có sự hiện diện của dung dịch NaOH và bột NaHCO3 trong môi trường nước. Ngoài ra, nhiệt độ phòng trong khoảng 20-25 độ C cũng là yếu tố quan trọng để phản ứng diễn ra.
Phản ứng trên là một phản ứng trung hòa, trong đó NaOH (natri hidroxit) là một chất bazơ mạnh, còn NaHCO3 (natri bicarbonate) là một muối bazơ yếu. Khi hai chất này tác dụng với nhau, NaOH sẽ tạo thành Na2CO3 (natri cacbonat), một muối bazơ mạnh, và nước, giúp điều chỉnh độ pH của dung dịch.
Phản ứng NaHCO3 + NaOH → Na2CO3 + H2O cũng được sử dụng trong quá trình sản xuất xà phòng. Trong quá trình này, NaOH được sử dụng để tách các axit béo từ các chất béo tự nhiên, trong khi NaHCO3 được sử dụng để loại bỏ các axit béo còn lại sau quá trình trích ly.
Đối với các ứng dụng khác, phản ứng này cũng được sử dụng để loại bỏ axit trong các dung dịch và điều chỉnh độ pH. Ngoài ra, nó còn được sử dụng trong sản xuất thuốc và các sản phẩm dược phẩm khác. Tuy nhiên, cần lưu ý rằng phản ứng này cũng có thể tạo ra khí CO2, do đó cần thực hiện trong môi trường có độ thông gió tốt.
Vì vậy, điều kiện cần để phản ứng NaHCO3 + NaOH → Na2CO3 + H2O xảy ra là có sự hiện diện của dung dịch NaOH và bột NaHCO3 trong môi trường nước, nhiệt độ phòng khoảng 20-25 độ C. Phản ứng này có thể được sử dụng để loại bỏ axit và điều chỉnh độ pH trong các dung dịch, và cũng được sử dụng trong sản xuất xà phòng, thuốc và các sản phẩm dược phẩm khác.
3. Ứng dụng của phản ứng NaHCO3 + NaOH → Na2CO3 + H2O:
Phản ứng NaHCO3 + NaOH → Na2CO3 + H2O là một phản ứng trung hòa, trong đó dung dịch NaOH được sử dụng để trung hòa axit trong dung dịch NaHCO3. Sau khi phản ứng xảy ra, sản phẩm Na2CO3 được tạo ra và dung dịch trở nên kiềm.
Dưới đây là một số ứng dụng của phản ứng NaHCO3 + NaOH → Na2CO3 + H2O:
3.1. Sản xuất xà phòng:
Na2CO3 được sử dụng để sản xuất xà phòng, bởi vì nó có khả năng tẩy rửa mạnh mẽ và có tính kiềm cao. Xà phòng đã và đang được sử dụng rộng rãi trong đời sống hàng ngày để làm sạch các bề mặt, đồ dùng và quần áo.
3.2. Làm sạch và tẩy rửa:
Dung dịch Na2CO3 được sử dụng để làm sạch và tẩy rửa các bề mặt bẩn, như là tẩy rửa chén bát, bồn tắm, vòi sen và những vật dụng khác. Nó còn được sử dụng để làm sạch tường và sàn nhà, giúp loại bỏ bụi bẩn và các vết bẩn khó chịu.
3.3. Sản xuất thuốc:
Na2CO3 được sử dụng để sản xuất một số loại thuốc như thuốc trị đau nhức và thuốc giảm đau. Nó cũng được sử dụng trong sản xuất các loại thuốc khác như thuốc trị sỏi thận và tá tràng, thuốc kháng viêm và thuốc trị bệnh gan.
3.4. Sử dụng trong công nghiệp thực phẩm:
Na2CO3 được sử dụng trong công nghiệp thực phẩm để điều chỉnh độ pH của thực phẩm và giúp phản ứng tẩy rửa tốt hơn. Nó cũng được sử dụng để làm giảm độ chua của một số loại thực phẩm như rượu và giấm.
3.5. Sử dụng trong sản xuất thủy tinh:
Na2CO3 được sử dụng để sản xuất thủy tinh, bởi vì nó có khả năng làm giảm nhiệt độ nóng chảy của các tinh thể khoáng chất. Nó cũng được sử dụng để làm giảm độ nhám của thủy tinh và tạo ra bề mặt thủy tinh sáng bóng.
Tóm lại, phản ứng NaHCO3 + NaOH → Na2CO3 + H2O là một phản ứng có rất nhiều ứng dụng trong đời sống và trong các lĩnh vực công nghiệp khác nhau. Các ứng dụng của nó đa dạng và có tính chất hữu ích, từ xà phòng, sản xuất thuốc tới sản xuất thủy tinh và công nghiệp thực phẩm.
4. Bài tập liên quan:
Câu 1. Cho V lít dung dịch NaOH 1M vào 200 ml dung dịch Al2(SO4)3 0,25M thì thu được kết tủa X và dung dịch Y. Sục khí CO2 tới dư vào dung dịch Y lại thu được 2,34 gam kết tủa. Giá trị của V là
A. 0,06
B. 0,23
C. 0,33
D. 0,43
Đáp án C
Câu 2. Chọn phát biểu đúng:
A. Dung dịch Na2CO3 có tính kiềm mạnh.
B. Dung dịch Na2CO3 có môi trường trung tính có Na2CO3 là muối trung hòa.
C. Dung dịch chứa Na2CO3 có môi trường axit do Na2CO3 là muối của axit yếu.
D. Na2CO3 dễ bị phân hủy khi đung nóng.
Đáp án A
Câu 3. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo môi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Đáp án A
Câu 4. Cho các dãy chắc hóa chất sau: Na, Na2O, NaCl, NaHCO3, Na2CO3. Số chất có thể tạo ra NaOH trực tiếp từ một phản ứng là:
A. 2
B. 3
C. 4.
D. 5.
Đáp án D
Câu 5. Hỗn hợp X chứa K2O, NH4Cl, KHCO3 và CaCl2 với số mol các chất bằng nhau. Cho hỗn hợp X vào nước dư và đun nóng. Các chất tan trong dung dịch thu được là:
A. KCl, NaOH, CaCl2.
B. KCl, KOH.
C. KCl, KHCO3, NH4Cl, CaCl2.
D. KCl.
Đáp án D
Câu 6. Trung hòa 50 gam dung dịch A chứa hỗn hợp HCl và H2SO4 cần vừa đủ 100 ml dung dịch B chứa NaOH 0,4M và Ba(OH)2 0,3M thu được 5,825 gam kết tủa. Nồng độ phần trăm của HCl trong dung dịch A là
A. 7,30%
B. 5,84%
C. 3,65%
D. 5,00%
Đáp án C
Câu 7. Cho 3,9 gam hỗn hợp 2 muối Na2CO3 và K2SO3 tác dụng với 200 ml dung dịch HCl, ta thu được một hỗn hợp khí A có tỉ khối hơi so với metan là 3,583 và dung dịch B. Để trung hòa lượng axit còn dư trong dung dịch B ta phải dùng hết 100 ml dung dịch Ba(OH)2 0,2M. Vậy % Na2CO3 và K2SO3 trong hỗn hợp ban đầu là:
A. 60,5% và 39,5%
B. 64% và 36%
C. 64,6% và 35,4%
D. 25,14% và 74,86%
Đáp án B
Câu 8. Có 4 chất rắn đựng trong 4 lọ riêng biệt không nhãn: Na2CO3, CaCO3, Na2SO4 và CaSO4.H2O. Chỉ dùng cặp hóa chất nào sau đây có thể nhận được cả 4 chất trên?
A. H2O và Na2CO3.
B. H2O và HCl.
C. H2SO4 và BaCl2.
D. H2O và KCl.
Đáp án A
Câu 9. Cho các dung dịch đựng trong các lọ mất nhãn sau: NaCl, Na2CO3, Na2SO3, Na2S, HCl. Chỉ dùng một chất nào sau đây có thể nhận biết được cả 5 chất trên?
A. Quì tím
B. H2SO4
C. Pb(NO3)2
D. BaCl2
Đáp án A
Câu 10. Kim loại kiềm có mạng tinh thể lập phương tâm khối,mật độ electron tự do thấp,điện tích ion nhỏ nên liên kết kim loại kém bền vững.Điều đó giúp giải thích tính chất nào sau này của kim loại kiềm?
A. Nhiệt độ nóng chảy thấp.
B. Mềm.
C. Nhiệt độ nóng chảy thấp và mềm
D. Khối lượng riêng nhỏ.
Đáp án C
Câu 11. Khi cho một miếng natri có hình dạng bất kì vào chậu nước có pha thêm vài giọt phenolphtalein. Hiện tượng nào không xảy ra trong thí nghiệm này?
A. Miếng natri trở nên có dạng hình cầu.
B. Dung dịch thu được làm quỳ tím hóa hồng.
C. Trong quá trình phản ứng, miếng natri chạy trên mặt nước.
D. Viên natri bị nóng chảy và nổi trên mặt nước.
Đáp án B
Câu 12. Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Đáp án A
Câu 13. Khi cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2 thì hiện tượng xảy ra là
A. xuất hiện kết tủa keo trắng
B. ban đầu không có hiện tượng gì, sau một thời gian xuất hiện kết tủa keo trắng
C. không có hiện tượng gì xảy ra
D. ban đầu xuất hiện kết tủa keo trắng, sau một thời gian kết tủa tan dần
Đáp án D
Câu 14. Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiện tượng quan sát được là
A. xuất hiện kết tủa keo trắng
B. lúc đầu xuất hiện kết tủa keo trắng sau đó kết tủa tan hết.
C. không có hiện tượng gì xảy ra
D. xuất hiện kết tủa keo trắng, sau đó kết tủa bị hoà tan một phần
Đáp án A