Phản ứng trên là một phản ứng thế hạt nhân trong đó brom (Br2) thay thế một nguyên tử hydro (H) trên vòng benzen (C6H6) để tạo ra sản phẩm bromua phenyl (C6H5Br) và axit hydrobromic (HBr). Đây là một ví dụ về phản ứng thế, trong đó một nguyên tử hoặc nhóm chức thay thế một nguyên tử hoặc nhóm chức khác trên một phân tử hữu cơ.
Mục lục bài viết
1. Phản ứng Benzen tác dụng Brom:
Phản ứng giữa benzen và brom là một trong những phản ứng hữu cơ rất quan trọng và được nghiên cứu rộng rãi trong lĩnh vực hóa học. Benzen là một hợp chất hữu cơ không màu, không tan trong nước, có mùi đặc trưng, là một trong những hợp chất hữu cơ quan trọng nhất được sử dụng trong cuộc sống hàng ngày. Trong khi đó, brom là một nguyên tố hóa học thuộc nhóm halogen, có màu đỏ nâu và có độc tính cao. Khi benzen tác dụng với brom, phản ứng sẽ tạo ra bromua phenyl và axit hydrobromic theo công thức phản ứng:
C6H6 + Br2 -> C6H5Br + HBr.
Trong phản ứng này, brom sẽ thay thế một trong các nguyên tử hydro trong phân tử benzen. Quá trình này diễn ra theo cơ chế tấn công điện tử. Các nguyên tử brom sẽ tấn công phân tử benzen, giải phóng một nguyên tử hydro và tạo ra hợp chất bromphenyl. Đồng thời, nguyên tử brom còn lại sẽ kết hợp với nguyên tử hydro được giải phóng để tạo thành axit hydrobromic.
2. Điều kiện phản ứng C6H6 ra C6H5Br:
Để phản ứng xảy ra, cần phải có điều kiện đúng, bao gồm nhiệt độ và xúc tác. Nhiệt độ thích hợp cho phản ứng này là khoảng 200-250 độ C. Ở nhiệt độ này, phản ứng sẽ diễn ra nhanh chóng và hiệu quả. Xúc tác bột sắt được sử dụng để tăng tốc độ phản ứng và giảm nhiệt độ cần thiết để phản ứng xảy ra. Điều này giúp giảm chi phí sản xuất và đảm bảo rằng phản ứng xảy ra đúng cách.
3. Hiện tượng phản ứng xảy ra giữa C6H6 và Br2:
Khi phản ứng diễn ra, màu của brom sẽ dần nhạt đi và ta có thể quan sát thấy khí hidro bromua (HBr) bốc ra khỏi dung dịch phản ứng. Điều này cho thấy phản ứng đã diễn ra thành công. Nếu không có xúc tác bột sắt, phản ứng sẽ diễn ra rất chậm hoặc không xảy ra. Ở nhiệt độ cao, phản ứng có thể làm hỏng cấu trúc benzen. Do đó, nhiệt độ và xúc tác là hai yếu tố rất quan trọng trong phản ứng này.
Trong công nghiệp, phản ứng này được sử dụng để sản xuất các hợp chất hữu cơ quan trọng như dyes, thuốc nhuộm, và thuốc trừ sâu. Các ứng dụng này phụ thuộc vào tính chất của hợp chất bromphenyl, và những tính chất này phụ thuộc vào điều kiện phản ứng.
Ngoài ra, phản ứng này còn được áp dụng trong một số nghiên cứu khoa học, như là một trong những phương pháp thiết lập cấu trúc các hợp chất hữu cơ. Việc nghiên cứu phản ứng này sẽ giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các hợp chất hữu cơ, và đóng góp vào việc phát triển các ứng dụng mới của chúng trong tương lai.
4. Tính chất hóa học của Benzen:
Benzen là một hợp chất hữu cơ không màu, có mùi thơm đặc trưng. Nó là một chất lỏng, nhẹ hơn nước và không hòa tan trong nước. Tuy nhiên, benzen có khả năng hòa tan trong các dung môi hữu cơ khác như etanol và axit axetic.
Benzen có cấu trúc phân tử đặc biệt, gồm 6 nguyên tử cacbon và 6 nguyên tử hydro, có liên kết hóa học giữa chúng để tạo thành vòng benzen. Tính chất hóa học của benzen rất đa dạng và phong phú. Có ba tính chất hóa học phổ biến của các chất thuộc đồng đẳng benzen hoặc các hiđrocacbon thơm, đó là phản ứng thế, phản ứng cộng và phản ứng oxi hóa.
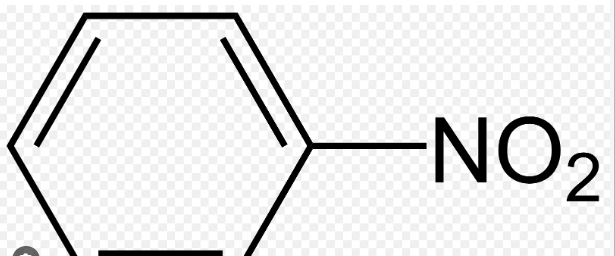
– Phản ứng thế là quá trình mà một nhóm thế (nhóm nguyên tử hoặc phân tử khác) thay thế cho một nguyên tử hydrogen trong vòng benzen. Ví dụ, khi benzen phản ứng với Br2, sản phẩm là C6H5Br và HBr (Fe, to). Khi phản ứng với HNO3, sản phẩm là C6H5NO2 và H2O (H2SO4 đặc, to).
– Phản ứng cộng là quá trình mà các hợp chất được thêm vào vòng benzen. Ví dụ, khi benzen phản ứng với 3 phân tử hidro, sản phẩm là xiclohexan (Ni, to). Khi phản ứng với 3 phân tử Cl2, sản phẩm là C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 – hexacloxiclohexan).
– Phản ứng oxi hóa là quá trình mà các nguyên tử trong vòng benzen bị mất đi electron. Benzen không làm mất màu dung dịch KMnO4. Khi oxi hóa hoàn toàn, sản phẩm là 6 phân tử CO2 và 3 phân tử H2O (to).
Tóm lại, benzen là một hợp chất hữu cơ quan trọng trong ngành hóa học. Tính chất hóa học đa dạng của nó đã mở ra nhiều cơ hội cho các ứng dụng trong lĩnh vực sản xuất thuốc, chất chống oxy hóa và các hợp chất tổng hợp khác.
5. Bài tập trắc nghiệm liên quan và lời giải:
Câu 1. Có các lọ đựng hóa chất riêng rẽ: Na2S, NaCl, AgNO3, Na2CO3. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó ?
A. dung dịch NaOH.
B. dung dịch H2SO4.
C. dung dịch HCl.
D. phenolphtalein.
Hướng dẫn giải
Đáp án C
Câu 2: Thể tích không khí cần dùng để đốt cháy hoàn toàn 0,1 mol benzen và 0,2 mol striren là (đo ở đktc):
A. 84 lít
B. 61,6 lít
C. 224 lít
D. 308 lít
Hướng dẫn giải
Đáp án D
C6H6 + 15/2 O2 → 6CO2 + 3H2O
Mol 0,1 → 0,75
→Vkk = VO2/20% = (0,75.22,4)/20% = 84 (lit)
Câu 3. Hóa chất để phân biệt: benzen, axetilen, striren là:
A. Dung dịch Brom
B. Dung dịch Brom, Dung dịch AgNO3/NH3
C. Dung dịch AgNO3
D. Cu(OH)2, dung dịch AgNO3/NH3
Hướng dẫn giải
Đáp án B
Trong thí nghiệm này, chúng ta đã thực hiện thêm KMnO4 vào các ống nghiệm chứa axetilen, stiren và benzen. Kết quả cho thấy, khi cho KMnO4 vào các ống nghiệm, màu của KMnO4 sẽ bị làm nhạt.
Sau đó, ta đã cho 2 dung dịch axetilen và stiren vào trong dung dịch AgNO3/ NH3 và đun nóng. Kết quả thu được cho thấy, ống chứa axetilen sẽ có lớp Ag màu trắng xám, trong khi ống chứa stiren vẫn không có hiện tượng gì xảy ra.
Để hiểu rõ hơn về kết quả này, ta có thể giải thích như sau: axetilen và stiren là hai hợp chất hữu cơ. Khi cho axetilen vào dung dịch AgNO3/ NH3 và đun nóng, phản ứng xảy ra giữa axetilen và ion Ag+ trong dung dịch AgNO3. Phản ứng này sẽ tạo ra lớp Ag màu trắng xám trên bề mặt của ống chứa axetilen. Tuy nhiên, stiren không phản ứng với dung dịch AgNO3/ NH3, do đó không có hiện tượng gì xảy ra.
Tóm lại, kết quả của thí nghiệm cho thấy rằng, các hợp chất hữu cơ như axetilen và stiren có thể tương tác với các chất hóa học khác nhau để tạo ra những hiện tượng khác nhau. Việc nghiên cứu và hiểu rõ về các phản ứng hóa học này không chỉ giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các hợp chất hữu cơ mà còn giúp chúng ta áp dụng chúng vào các ứng dụng khác nhau trong đời sống.
Câu 4. Benzen tác dụng với Cl2 có ánh sáng, thu được hexaclorua. Công thức của hexaclorua là
A. C6H6Cl2
B. C6H6Cl6
C. C6H5Cl
D. C6H6Cl4
Hướng dẫn giải
Đáp án B
Câu 5. TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
A. 550,0 gam.
B. 687,5 gam.
C. 454,0 gam.
D. 567,5 gam.
Hướng dẫn giải
Đáp án C
C6H5CH3 + 3HNO3 C6H2(NO2)3CH3 + 3H2O (1)
gam: 92 → 227
gam: 230.80% → x
Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluen) tạo thành từ 230 gam toluen với hiệu suất 80% là :
x = (230 . 80% . 227)/ 92 = 454 gam.
Câu 6. Chất X là đồng đẳng của benzen, có công thức đơn giản nhất là C3H8. Công thức phân tử của của X là
A. C3H4
B. C6H8
C. C9H12
D. C12H16
Hướng dẫn giải
Đáp án C
Câu 7. Chọn dãy hóa chất phù hợp để điều chế toluen?
A. C6H5Br, Na, CH3Br
B. C6H6, AlCl3, CH3Cl
C. C6H6, Br2 khan, CH3Br, bột sắt, Na
D. Tất cả đều đúng
Hướng dẫn giải
Đáp án D
Câu 8. Phản ứng nào sau đây chứng tỏ benzen có tính chất của hidrocacbon không no?
A. Phản ứng với dung dịch KMnO4
B. Phản ứng với brom khan có mặt bột Fe
C. Phản ứng với clo chiếu sáng
D. Phản ứng nitro hóa
Hướng dẫn giải
Đáp án C: C6H6 + Cl2 → C6H5Cl + HCl
Câu 9. Benzen, strizen, naphtalen, chất nào bị oxi hóa với thuốc tím?
A. Cả ba chất
B. Striren
C. Naphtalen
D. Benzen và naphtalen
Hướng dẫn giải
Đáp án B
Câu 10. Khi cho một ít benzen vào ống nghiệm đựng nước Brom, lắc nhẹ. Hiện tượng quan sát được là
A. nước brom mất màu, thu được chất lỏng đồng nhất
B. chất lỏng trong ống nghiệm chia thành 2 lớp: lớp có màu đỏ và lớp màu
C. chất lỏng trong ống nghiệm không thay đổi
D. nước brom mất màu, có chất lỏng không tan chìm xuống đáy ống nghiệm
Hướng dẫn giải
Đáp án D
Khi cho một ít benzen vào ống nghiệm đựng nước Brom, lắc nhẹ. Hiện tượng quan sát được là nước brom mất màu, có chất lỏng không tan chìm xuống đáy ống nghiệm
Câu 11. Benzen không có tính chất nào sau đây?
A. Cộng hidro trong điều kiện thích hợp tạo thành C6H12
B. Cộng Clo tạo thành C6H6Cl6
C. Thế nguyên tử hidro bằng nguyên tử Brom (có mặt bột sắt) tạo thành brombenzen
D. Tác dụng với nước tạo thành C6H7OH
Hướng dẫn giải
Đáp án D
Câu 12. Trong không khí có một lượng benzen đáng kể gây ô nhiễm môi trường. Đó là do
A. trong thành phần của xăng có một lượng benzen làm tăng chỉ số octan của xăng, benzen không cháy hết nên được phát thải vào không khí.
B. Do trong phản ứng cháy của xăng có một lượng benzen được tạo ra phản ứng của các thành phần trong xăng với nhau
C. do các sản phẩm cháy của xăng tác dụng với không khí sinh ra benzen
D. do một số loại cây tiết ra benzen phát thải vào không khí.
Hướng dẫn giải
Đáp án A
Trong không khí có một lượng benzen đáng kể gây ô nhiễm môi trường. Đó là do trong thành phần của xăng có một lượng benzen làm tăng chỉ số octan của xăng, benzen không cháy hết nên được phát thải vào không khí.
Câu 13. Phản ứng benzen tác dụng với clo tạo C6H6Cl6 xảy ra trong điều kiện:
A. Có bột Fe xúc tác
B. Có ánh sáng khuyếch tán
C. Có dung môi nước
D. Có dung môi CCl4
Hướng dẫn giải
Đáp án B
Câu 14. Nhận định nào sau đây là sai?
A. Benzen có khả năng tham gia phản ứng thế tương đối dễ hơn phản ứng cộng.
B. Benzen tham gia phản ứng thế dễ hơn ankan.
C. Các đồng đẳng của benzen làm mất màu dung dịch thuốc tím khi đun nóng.
D. Các nguyên tử trong phân tử benzen cùng nằm trên một mặt phẳng.
Hướng dẫn giải
Đáp án B
Nhận định sai “Benzen tham gia phản ứng thế dễ hơn ankan”.
Câu 15. Khẳng định nào sau đây không đúng khi nói về stiren ?
A. Stiren tham gia phản ứng trùng hợp.
B. Stiren là đồng đẳng của benzen.
C. Stiren làm mất màu dung dịch Br2 .
D. Stiren là chất lỏng, không màu, không tan trong nước.
Hướng dẫn giải
Đáp án B
Câu 16. Cho các nhận định sau:
(1) Dẫn khí etilen qua dung dịch brom có màu da cam, sau phản ứng dung dịch brom bị mất màu.
(2) Pentan không làm mất màu dung dịch KMnO4.
(3) Tất cả ankin đều tác dụng với dung dịch AgNO3/NH3 tạo kết tủa vàng.
(4) Propilen cộng nước thu được sản phẩm chính ancol bậc II.
(5) Benzen làm mất màu dung dịch Br2 ở mọi điều kiện.
Số nhận định đúng là
A. 3.
B. 4.
C. 5.
D. 2.
Hướng dẫn giải
Đáp án A
(1) đúng
Phương trình hóa học: CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br
(2) đúng, vì pentan là ankan không làm mất màu dung dịch KMnO4.
(3) sai, chỉ có ank-1-in tác dụng được với dung dịch AgNO3/NH3 tạo kết tủa vàng.
(4) đúng, vì propilen cộng nước thu được sản phẩm chính là ancol bậc II (theo quy tắc cộng Maccopnhicop).
Phương trình hóa học: CH2=CH-CH3 + H2OCH3-CH(OH)-CH3.
(5) sai, vì benzen không phản ứng với dung dịch Br2 ở mọi điều kiện, (chỉ phản ứng với brom khan khi có xúc tác Fe, to).
⟹ Có tất cả 3 nhận định đúng.
Câu 17. Cho các phát biểu sau:
(1) Nhỏ vài giọt dung dịch nước Br2 vào phenol thấy dung dịch brom nhạt màu và có kết tủa trắng xuất hiện.
(2) Hidro hóa axetilen (xúc tác Pd/PbCO3, to)bằng một lượng vừa đủ hidro thu được eten.
(3) Để phân biệt but-2-en và but-2-in ta có thể sử dụng dung dịch AgNO3/NH3
(4) Trong công nghiệp có thể điều chế axit axetic bằng cách oxi hóa rượu etylic.
Số phát biểu đúng là:
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án C
(1) Nhỏ vài giọt dung dịch nước Br2 vào phenol thấy dung dịch brom nhạt màu và có kết tủa trắng xuất hiện.
(2) Hidro hóa axetilen (xúc tác Pd/PbCO3,to)bằng một lượng vừa đủ hidro thu được eten.
(4) Trong công nghiệp có thể điều chế axit axetic bằng cách oxi hóa rượu etylic.