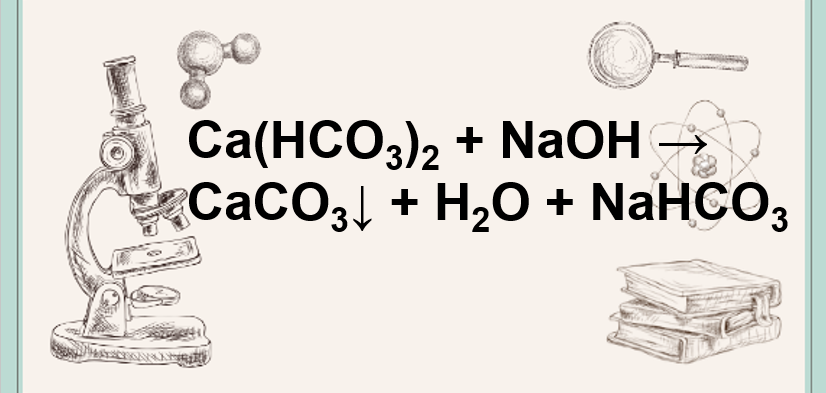Khi Ba(HCO3)2 phản ứng với NaOH, sản phẩm thu được bao gồm BaCO3, Na2CO3 và H2O. Phản ứng này là một ví dụ về phản ứng trung hòa, trong đó axit và bazơ tương tác với nhau để tạo ra muối và nước. Phương trình hóa học cho phản ứng này là: Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O
Mục lục bài viết
1. Phản ứng hóa học giữa Ba(HCO3)2 và NaOH:
Khi Ba(HCO3)2 phản ứng với NaOH, sản phẩm thu được bao gồm BaCO3, Na2CO3 và H2O. Phản ứng này là một ví dụ về phản ứng trung hòa, trong đó axit và bazơ tương tác với nhau để tạo ra muối và nước.
Phương trình hóa học cho phản ứng này là:
Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O
Trong đó, Ba(HCO3)2 và NaOH là các chất đầu vào (không phản ứng được với nhau), BaCO3 và Na2CO3 là các chất đầu ra (được tạo ra từ phản ứng), và H2O là sản phẩm phụ.
Trong quá trình phản ứng, Ba(HCO3)2 và NaOH tương tác với nhau để tạo ra BaCO3 và Na2CO3, hai muối tan trong nước. H2O được tạo ra như sản phẩm phụ. Phản ứng này có thể được sử dụng để tạo ra các muối cacbonat của các kim loại khác nhau.
Để hiểu rõ hơn về tính chất của phản ứng này, chúng ta có thể xem xét các tính chất của các chất đầu vào và chất đầu ra. Ba(HCO3)2 và NaOH đều là các chất tan trong nước, và khi tương tác với nhau, chúng tạo ra hai muối cacbonat tan trong nước và nước. BaCO3 và Na2CO3 cũng là các muối tan trong nước, và có thể được sử dụng trong nhiều ứng dụng khác nhau.
Tổng quan về phản ứng hóa học giữa Ba(HCO3)2 và NaOH, đây là một phản ứng trung hòa tạo ra hai muối cacbonat tan trong nước và nước. Phản ứng này có thể được sử dụng để tạo ra các muối cacbonat của các kim loại khác nhau, và có nhiều ứng dụng trong các ngành công nghiệp khác nhau.
2. Điều kiện xảy ra phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O:
Phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O là một phản ứng trung hòa trong đó Ba(HCO3)2 và NaOH tác dụng với nhau để tạo ra BaCO3, Na2CO3 và 2 phân tử nước. Để đảm bảo phản ứng này diễn ra hiệu quả và đạt được hiệu suất cao, người thực hiện phản ứng cần chú ý đến một số điều kiện cơ bản như sau:
– Tương đương về mặt stơchiometry giữa Ba(HCO3)2 và NaOH: Để đạt được hiệu suất cao trong quá trình phản ứng, cần phải đảm bảo lượng Ba(HCO3)2 và NaOH đầy đủ và tương đương về mặt stơchiometry. Nếu tỷ lệ này không đúng, phản ứng sẽ không hoàn thành hoặc sẽ sinh ra các sản phẩm phụ không mong muốn.
– Nhiệt độ phản ứng: Nhiệt độ phản ứng cũng là một yếu tố cực kỳ quan trọng trong quá trình thực hiện phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O. Thông thường, nhiệt độ được duy trì ở mức trung bình khoảng 25-30 độ C. Nếu nhiệt độ quá cao hoặc quá thấp, đều có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng.
– Lò xoay: Để đảm bảo hỗn hợp phản ứng được khuấy đều và đồng đều trong suốt quá trình thực hiện, người thực hiện phản ứng cần sử dụng lò xoay để khuấy hỗn hợp phản ứng. Việc này giúp tăng khả năng tiếp xúc giữa các chất tham gia phản ứng và cải thiện hiệu suất của phản ứng.
– Lọc hoặc kết tủa: Sau khi phản ứng hoàn thành, sản phẩm cần được lọc hoặc kết tủa để tách ra khỏi dung dịch. Điều này giúp lấy được sản phẩm mong muốn và loại bỏ các chất phụ hoặc chất còn lại không mong muốn.
Một số điều kiện khác cũng có thể ảnh hưởng đến hiệu suất của phản ứng, bao gồm thời gian phản ứng, pH của dung dịch, tốc độ khuấy và áp suất. Để đảm bảo phản ứng diễn ra thành công, người thực hiện phản ứng cần chú ý đến những điều kiện này.
Ngoài ra, phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O còn được ứng dụng trong nhiều lĩnh vực khác nhau như sản xuất sơn, thuốc nhuộm và chất tẩy rửa. Hiệu suất của phản ứng cũng được cải thiện bằng cách sử dụng các chất xúc tác như hidroxit natri hay sodium acetate.
Với những điều kiện trên, phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O sẽ được thực hiện thành công và đạt được hiệu suất cao.
3. Ứng dụng của phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O:
Phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O là một trong những phản ứng hóa học cơ bản được sử dụng trong nhiều lĩnh vực khác nhau. Trong đó, đáng chú ý là các ứng dụng của phản ứng này trong sản xuất giấy, sản xuất hóa chất, phân tích hóa học và tẩy uế.
3.1. Trong sản xuất giấy:
Trong quá trình sản xuất giấy, nước thải được sinh ra từ quá trình sản xuất giấy chứa nhiều chất độc hại và tạp chất khác. Việc xử lý nước thải là một trong những vấn đề quan trọng trong ngành giấy và phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O đã được sử dụng như một phương pháp xử lý nước thải hiệu quả. Phản ứng này tạo ra BaCO3 và Na2CO3, các chất kiềm mạnh giúp tẩy rửa các chất độc hại và tạp chất khác trong nước thải của nhà máy giấy.
3.2. Trong sản xuất hóa chất:
BaCO3 là một chất trung gian quan trọng trong quá trình sản xuất nhiều hợp chất hữu cơ và vô cơ. Phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O được sử dụng để sản xuất BaCO3, một chất trung gian quan trọng trong quá trình sản xuất hóa chất.
3.3. Trong phân tích hóa học:
Phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O được sử dụng để phân tích hàm lượng CO2 trong mẫu khí. Trong phương pháp này, mẫu khí được cho vào dung dịch NaOH để hấp thụ CO2, sau đó phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O được sử dụng để chuyển đổi CO2 hấp thụ thành BaCO3. BaCO3 được thu thập và cân để tính toán hàm lượng CO2 có trong mẫu khí.
3.4. Trong tẩy uế:
BaCO3 được sử dụng để tẩy uế các vết bẩn cứng đầu. Để làm điều này, BaCO3 được trộn với nước để tạo thành một dung dịch, sau đó dung dịch này được đổ lên các vết bẩn trên bề mặt vật liệu cần tẩy uế. Phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O xảy ra khi dung dịch tiếp xúc với vết bẩn, và các sản phẩm của phản ứng này giúp loại bỏ các chất bẩn và tạp chất từ bề mặt vật liệu.
Ngoài ra, phản ứng Ba(HCO3)2 + 2NaOH → BaCO3 + Na2CO3 + 2H2O còn có thể có nhiều ứng dụng khác tùy thuộc vào từng lĩnh vực cụ thể. Các nghiên cứu tiếp tục được thực hiện để khai thác tối đa các tiềm năng và ứng dụng của phản ứng này.
4. Câu hỏi trắc nghiệm liên quan:
Câu 1. Axit H3PO4 và HNO3 cùng phản ứng được với tất cả các chất trong dãy nào dưới đây?
A. CuCl2, KOH, NH3, Na2CO3.
B. KOH, NaHCO3, NH3, ZnO.
C. MgO, BaSO4, NH3, Ca(OH)2.
D. NaOH, KCl, NaHCO3, H2S.
Câu 2. Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
A. Na2CO3, Na2SO3, NaCl
B. CaCO3, Na2SO3, BaCl2
C. BaCO3, BaCl2, CaCl2
D. CaCl2, Na2CO3, Cu(NO3)2
Câu 3. Kim loại nào sau đây vừa tác dụng với dung dịch HCl vừa tác dụng với NaOH?
A. Cu
B. Zn
C. Al
D. Ag
Câu 4. Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
A. NaCl và KOH.
B. H2SO4 và KOH.
C. H2SO4 và CaCl2.
D. KCl và AgNO3.
Câu 5. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch Cu(NO3)2, Fe(NO3)3, Mg(NO3)2 ta dùng:
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch KOH
Câu 6. Cho dung dịch Ba(HCO3)2 lần lượt tác dụng với các dung dịch sau: CaCl2, Ca(NO3)2, NaOH, NaHSO4, Ca(OH)2, H2SO4, HCl. Số phản ứng tạo ra kết tủa là
A. 3
B. 4
C. 5
D. 6
Câu 7. Cho các phương pháp:
(1) đun nóng trước khi dùng;
(2) dùng dung dịch Ca(OH)2 vừa đủ;
(3) dùng dung dịch Na2CO3;
(4) dùng dung dịch NaCl;
(5) dùng dung dịch HCl.
Người ta có thể làm mềm nước cứng tạm thời bằng phương pháp nào?
A. 1, 2
B. 3, 4
C. 2, 4
D. 1, 2, 3
Câu 8. Có 4 dung dịch mất nhãn riêng biệt sau: NaOH, H2SO4, HCl, Na2CO3. Chỉ dùng thêm hoá chất nào sau đây để phân biệt 4 dung dịch trên
A. Dung dich BaCl2.
B. Dung dich phenolphtalein.
C. Dung dich NaHCO3.
D. Quy tím.
Đáp án A
Câu 9. Khi cho dung dịch NaOH dư vào cốc đựng dung dịch Ca(HCO3)2 trong suốt thì trong cốc:
A. Sủi bọt khí
B. Không có hiện tượng gì
C. Xuất hiện kết tủa trắng
D. xuất hiện kết tủa trắng và bọt khí
Câu 10. Tiến hành các thí nghiệm sau:
(a) Cho kim loại Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch KOH.
(c) Cho Na2CO3 vào dung dịch Ba(HCO3)2 (ti lệ 1:1)
(d) Cho bột Fe dư vào dung dịch FeCl3.
(e) Cho hỗn hợp BaO và Al2O3 (tỉ lệ 1: 1) vào nước dư.
(g) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol 1:1) vào dung dịch HCl dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa một muối là
A. 3.
5.
C. 2.
D. 4.
Câu 11. Dãy các hợp chất vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH là:
A. AlCl3, Al2O3, Al(OH)3
B. Al2O3, Al(OH)3, NaHCO3
C. Zn(OH)2, Al2O3, Na2CO3
D. ZnO, Cu(OH)2, NH4NO3